题目内容
2.某研究小组利用如图装置探究SO2和Fe(NO3)3溶液的反应原理.已知:0.4mol/L的Fe(NO3)3溶液的pH=l.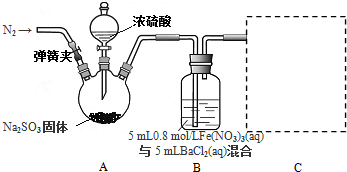
请按要求回答下列问题:
(1)检验装置A气密性的操作方法:在B中加入适量水,连接好装置A、B,关闭弹簧夹及分液漏斗的活塞,将B中导气管深入到B的水液面以下,手握烧瓶,若B导管中有气泡冒出,松开手,B中有液柱回流,则气密性好.
装置A中反应的化学方程式是Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O.
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹.
(3)在C处虚线框内画出尾气吸收的装置图(标注试剂).
(4)装置B中产生了白色沉淀,其成分是BaSO4,说明SO2具有还原性.
(5)猜想B中产生白色沉淀的原因:
猜想1.SO2和Fe3+、酸性条件下NO3-都反应;
猜想2:由于SO2与Fe3+反应;
猜想3:由于在酸性条件下SO2与NO3-反应.
①若猜想2成立,装置B中依次可能发生反应的离子方程式:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,SO42-+Ba2+=BaSO4↓.
②为验证猜想3成立,可在相同条件下进行实验,将装置B中的Fe(NO3)3溶液替换为下列试剂是(填序号)C.
a.5mL 2.4mol/L稀硝酸
b.5mL 0.8mol/L FeCl3溶液
c.2.5mL 0.4mol/L盐酸和2.5mL 4.8mol/L NaNO3溶液.
分析 (1)装置气密性检验的原理是:通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;装置A中亚硫酸钠和浓硫酸反应生成二氧化硫和硫酸钠;
(2)为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出;
(3)尾气主要为二氧化硫,所以C处虚线框内画出尾气吸收的装置中试剂需选择碱性溶液,同时需有防倒吸的装置;
(4)二氧化硫具有还原性,可与硝酸根离子发生氧化还原反应生成硫酸根离子,进而生成硫酸钡沉淀;
(5)Fe3+和Fe2+都具有氧化性,都可与二氧化硫反应,可根据反应产物进行判断,装置B中的Fe(NO3)3溶液替换需硝酸根离子浓度相同、溶液的PH相同.
解答 解:(1)装置气密性的检查一般常用加热法,依据的原理是:通过加热(用酒精灯或热毛巾或体温)密闭容器,使其中的气体受热膨胀,压强变大,导致放入水中的导管口有气泡冒出(导管应先放入水中),移开热源后,由于装置中的气体遇冷收缩、压强变小,又会在导管里形成一段水柱,检验装置A气密性的操作方法:在B中加入适量水,连接好装置A、B,
关闭弹簧夹及分液漏斗的活塞,将B中导气管深入到B的水液面以下,手握烧瓶,若B导管中有气泡冒出,松开手,B中有液柱回流,装置A中反应的化学方程式是Na2SO3+H2S04(浓)=Na2S04+SO2↑+H2O,
故答案为:关闭弹簧夹及分液漏斗的活塞,将B中导气管深入到B的水液面以下,手握烧瓶,若B导管中有气泡冒出,松开手,B中有液柱回流;Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2)为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出,操作为打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹,
故答案为:打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹;
(3)尾气的主要成分为二氧化硫,通常用氢氧化钠溶液吸收,为防止倒吸,需用倒扣的漏斗,所以装置如图: ,
,
故答案为: ;
;
(4)二氧化硫具有还原性,可与硝酸根离子发生氧化还原反应生成硫酸根离子,进而生成硫酸钡沉淀,
故答案为:BaSO4;还原性;
(5)两种离子都氧化二氧化硫,即SO2和Fe3+、酸性条件下NO3-都反应;
故答案为:猜想1:SO2和Fe3+、酸性条件下NO3-都反应;
①按观点2,装置B中反应的离子方程式是SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,SO42-+Ba2+=BaSO4↓,可通过检验是否有Fe2+生成的方法判断,具体做法为取少量B中溶液于试管中,加入少量铁氰化钾[K3Fe(CN)6]溶液产生蓝色沉淀,则溶液中有Fe2+,观点2合理,也可根据生成白色沉淀判断,
故答案为:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+;SO42-+Ba2+=BaSO4↓;
②按观点3,在酸性条件下SO2与NO3-反应,实验中c(NO3-)=1.2mol/L,pH=l,则可用2.5mL 0.4mol/L盐酸和2.5mL 4.8mol/L NaNO3溶液代替,
故答案为:c.
点评 本题探究SO2和Fe(NO3)3溶液的反应原理实验,题目难度中等,注意把握物质的性质为解答该题的关键,学习中注意相关知识的积累,培养了学生灵活运用知识的能力.

| A. | 甲醇,乙醇 | B. | 乙醇,1-丙醇 | C. | 2-丙醇和1-丁醇 | D. | 无法判断 |
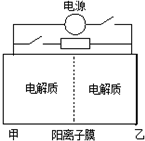 如图是一种蓄电池的示意图.被膜隔开的电解质分别为Na2S2和 NaBr3,放电后变为Na2S4和NaBr.已知放电时Na+ 由乙池向甲池移动.下面对该装置工作过程中叙述正确的是( )
如图是一种蓄电池的示意图.被膜隔开的电解质分别为Na2S2和 NaBr3,放电后变为Na2S4和NaBr.已知放电时Na+ 由乙池向甲池移动.下面对该装置工作过程中叙述正确的是( )| A. | 放电过程,甲池发生氧化反应 | |
| B. | 放电过程,电池反应:2S22-+Br3-=S42-+3Br- | |
| C. | 充电过程,乙池为阳极室 | |
| D. | 充电过程,当阳极室阴离子增加了2mol,整个电路中电子转移2mol |
| A. | 原子半径:W>Z>Y | |
| B. | Y形成的离子与Z形成的离子的电子数可能相同 | |
| C. | 化合物ZY、WY3 中化学键的类型相同 | |
| D. | 由X、Y、Z、W组成的化合物的水溶液不可能显酸性 |
| A. | 棉布、羊毛和涤纶燃烧后都只生成二氧化碳和水 | |
| B. | 乙酸乙酯和食用植物油均可水解生成乙醇 | |
| C. | 氢氧化铝、氢氧化钠、碳酸钠都是常见的胃酸中和剂 | |
| D. | 生物柴油和石化柴油相比,使用生物柴油环保,可以减少SO2的排放,且生物柴油属于可再生能源 |
| A. | 中子数为79、质子数为55 的铯(Cs)原子:${\;}_{55}^{79}$Cs | |
| B. | N2分子的电子式: | |
| C. | HOCH2COOH缩聚物的结构简式: | |
| D. | 镁离子的结构示意图: |
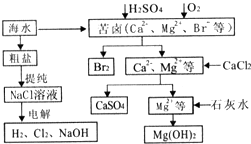 工业上对海水资源综合开发利用的部分工艺流程如图所示.
工业上对海水资源综合开发利用的部分工艺流程如图所示.

 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ .
. .
.