题目内容
11. 如图所示的原电池中:
如图所示的原电池中:①负极材料是Cu,电极反应式是Cu-2e-=Cu2+
②正极材料是石墨,电极反应式是2Fe3++2e-=2Fe2+.
③该原电池的总反应式为:2Fe3++Cu═2Fe2++Cu2+.
分析 自发的氧化还原反应为:2Fe3++Cu═2Fe2++Cu2+,即为电池的总反应,其中Cu作负极,失电子发生氧化反应,正极材料是石墨电极,Fe3+在正极上得电子发生还原反应.
解答 解:①自发的氧化还原反应为:2Fe3++Cu═2Fe2++Cu2+,其中Cu作负极,失电子发生氧化反应,电极反应式是Cu-2e-=Cu2+,故答案为:Cu;Cu-2e-=Cu2+;
②正极材料是石墨电极,Fe3+在正极上得电子发生还原反应,电极反应式为:2Fe3++2e-=2Fe2+;故答案为:石墨;2Fe3++2e-=2Fe2+;
③该原电池的总反应式为:2Fe3++Cu═2Fe2++Cu2+,故答案为:2Fe3++Cu═2Fe2++Cu2+.
点评 本题考查了据氧化还原反应方程式设计原电池,题目难度不大,注意把握原电池中正负极的判断和电极方程式的书写方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.一个原子在第三电子层有10个电子,该原子第三电子层电子排布可以写成( )
| A. | 3s23p8 | B. | 3d10 | C. | 3s23p64s2 | D. | 3s23p63d2 |
2.将下列气体通入水中,既能生成含氧酸,又能生成无氧酸的是( )
| A. | 氯气 | B. | 二氧化氮 | C. | 二氧化碳 | D. | 二氧化硫 |
19.pH均为2的HCl和CH3COOH的两种溶液各1L,分别加入足量的Na2CO3粉末,下列说法正确的是( )
| A. | 二者反应的平均速率相等 | B. | 二者溶质的物质的量浓度不相等 | ||
| C. | 二者生成二氧化碳的体积相等 | D. | 二者中氢离子的浓度不相等 |
6.磷元素的原子结构示意图为 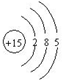 ,则磷元素位于周期表中( )
,则磷元素位于周期表中( )
 ,则磷元素位于周期表中( )
,则磷元素位于周期表中( )| A. | 第3周期,第ⅢA族 | B. | 第5周期,第ⅤA族 | C. | 第5周期,第ⅢA族 | D. | 第3周期,第ⅤA族 |
16.下列反应中,属于加成反应的是( )
| A. | CH2=CH2+HCl$→_{△}^{催化剂}$CH3CH2Cl | |
| B. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| C. |  | |
| D. | CH3CH2Br+NaOH$→_{△}^{乙醇}$CH2=CH2↑+NaBr+H2O |
3.若要将0.6mol甲烷完全和氯气发生取代反应,并且生成相同物质的量的四种取代物,则需要氯气的物质的量为( )
| A. | 1.5 mol | B. | 1.25 mol | C. | 1.6 mol | D. | 2.5 mol |
20.下列离子方程式正确的是( )
| A. | Ca(HCO3)2与少量NaOH溶液的反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| B. | 少量SO2通入NaClO溶液中:3ClO-+SO2+H2O═Cl-+SO42-+2HClO | |
| C. | 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-═2Mn2++10CO2↑+8H2O | |
| D. | NH4HSO4和少量Ba(OH)2溶液反应NH4++H++SO42-+Ba2++2OH-═BaSO4↓+NH3•H2O+H2O |