题目内容
1.A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A的最外层电子数是次外层电子数的2倍,B是短周期中金属性最强的元素,C是同周期中阳离子半径最小的元素,D元素的最高价氧化物是石英的主要成分,且与B元素的最高价氧化物对应水化物反应的产物M是制备木材防火剂的原料,E的单质在常温下为黄色晶体.请回答:(1)F在元素周期表中的位置是第三周期第ⅦA族.
(2)元素的非金属性(原子的得电子能力):A弱于E(填“强于”或“弱于”).
(3)M的水溶液俗称水玻璃.
(4)将一定量的B单质在氧气中燃烧的产物与一定量的C单质同时放入水中,产生两种无色气体,反应后恰好无固体剩余,则B单质与C单质的质量之比为23:27.
(5)工业上将干燥的F单质通入熔融的E单质中可制得化合物E2F2.该物质可与水反应生成一种能使品红溶液褪色的气体,同时还有E单质生成,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,则该反应的化学方程式为2S2Cl2+2H2O═3S↓+SO2↑+4HCl.
分析 A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A的最外层电子数是次外层电子数2倍,A原子只能有2个电子层,最外层电子数为4,则A为碳元素;B是短周期中金属性最强的元素,则B为Na;结合原子序数可知,C、D、E、F都处于第三周期,C是同周期中阳离子半径最小的元素,则C为Al;D元素的最高价氧化物是石英的主要成分,则D为Si,D与B元素的最高价氧化物对应水化物反应的产物M是制备木材防火剂的原料,则M为Na2SiO3;E的单质在常温下为黄色晶体,故E为硫元素,F的原子序数最大,故F为Cl,据此解答.
解答 解:A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A的最外层电子数是次外层电子数2倍,A原子只能有2个电子层,最外层电子数为4,则A为碳元素;B是短周期中金属性最强的元素,则B为Na;结合原子序数可知,C、D、E、F都处于第三周期,C是同周期中阳离子半径最小的元素,则C为Al;D元素的最高价氧化物是石英的主要成分,则D为Si,D与B元素的最高价氧化物对应水化物反应的产物M是制备木材防火剂的原料,则M为Na2SiO3;E的单质在常温下为黄色晶体,故E为硫元素,F的原子序数最大,故F为Cl.
(1)F为Cl元素,在元素周期表中的位置是:第三周期第ⅦA族,
故答案为:第三周期第ⅦA族;
(2)碳酸为弱酸,而硫酸为强酸,故元素的非金属性(原子的得电子能力):碳弱于硫,
故答案为:弱于;
(3)M为硅酸钠,水溶液俗称水玻璃,
故答案为:水玻璃;
(4)由关系式:2Na→Na2O2→2NaOH,反应方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑,可知n(Na)=n(Al),则m(Na):m(Al)=23g/mol:27g/mol=23:27,
故答案为:23:27;
(5)化合物S2Cl2可与水反应生成一种能使品红溶液褪色的气体,该气体为SO2,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,故S元素化合价降低,转移0.3mol电子生成二氧化硫为0.1mol,故有0.3molS原子发生还原反应,根据电子转移守恒可知S元素在还原产物中的化合价为0,故生成S,同时生成HCl,该反应的化学方程式为:2S2Cl2+2H2O═3S↓+SO2↑+4HCl,
故答案为:2S2Cl2+2H2O═3S↓+SO2↑+4HCl.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,综合考查学生运用知识分析问题、解决问题的能力,(4)中关键是明确发生的反应判断最终恰好生成偏铝酸钠,难度中等.

| A. | 甲苯与硝酸制TNT | B. | 甲烷与氯气制备一氯甲烷 | ||
| C. | 溴乙烷水解制乙醇 | D. | 乙烯聚合为聚乙烯高分子材料 |
| A. | 铝片与盐酸反应 | B. | 小苏打粉末与盐酸反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl晶体反应 | D. | 稀氨水与稀硫酸反应 |
| A. | 丙烯分子中所有的原子都在同一平面上 | |
| B. | 丙烯分子中三个碳原子有可能在同一条直线上 | |
| C. | 过量的丙烯通入浓溴水中,观察到溴水褪色,溶液均一稳定 | |
| D. | 丙烯既可以发生加成反应,又可以发生取代反应 |
| A. | 位于周期表中同一周期的元素,原子具有相同的电子层数 | |
| B. | 凡是位于周期表中同一周期的元素,都是按从左到右的顺序原子核外最外层电子数由1递增至8 | |
| C. | 凡是位于周期表中同一主族的元素,原子具有相同的最外层电子数 | |
| D. | 凡是位于周期表中同一主族的元素,都是按从上到下的顺序原子核外电子层数逐渐递增 |
 如图所示的原电池中:
如图所示的原电池中: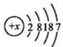
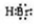 、CaBr2:
、CaBr2: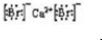 .
.