题目内容
2.为研究铁与热浓硫酸的反应,某学习小组设计了下图,进行探究活动: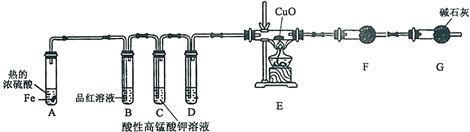
实验中观察到的部分现象如下:开始时,B、C中均有气泡产生;随后气泡量减少,B中溶液褪色,C中溶液颜色变浅;一段时间后,C、D中的气泡量又会明显增加.
(1)仪器G的名称是干燥管,其作用是防止空气中的水进入F装置.
(2)“一段时间后气泡量又会明显增加”的原因是(只用化学方程式表示):Fe+H2SO4═H2↑+FeSO4.
(3)装置D中的药品是浓硫酸,F中的药品是无水硫酸铜,其作用是检验水的生成,
(4)E中的实验现象是黑色固体变红.
(5)若A中反应后铁有剩余,将所得溶液久置于空气中会生成红褐色絮状物,用一离子方程式表示其变化:12Fe2++3O2+6H2O═4Fe(OH)3↓+8Fe3+.
(6)若足量的铁与10mL18.0mol•L-1的浓H2SO4在上述装置中反应完全,测得反应前后E装置的质量减少了0.32g,则A中所得的FeSO4溶液物质的量浓度为10mol•L-1.(假设溶液体积不变)
分析 加热条件下,Fe与浓硫酸反应生成二氧化硫,当硫酸浓度减小,变为稀硫酸时,生成氢气,检验二氧化硫用品红溶液,生成的氢气与CuO反应生成水蒸气,通过检验水蒸气的存在,可以证明生成了氢气,所以D装置要干燥氢气,F装置为无水硫酸铜检验水蒸气,G装置是为了防止空气中的水蒸气产生干扰;
(1)根据装置图分析;G装置是为了防止空气中的水蒸气产生干扰;
(2)浓硫酸变为稀硫酸时,与Fe反应生成氢气;
(3)D中药品是用来干燥氢气;无水硫酸铜遇水变蓝色;
(4)在加热条件下,CuO与氢气反应生成Cu;
(5)若A中反应后铁有剩余,则溶液转化Fe为Fe2+,Fe2+在空气中能被氧气氧化为Fe3+;
(6)根据Fe+2H2SO4═SO2↑+FeSO4+H2O,Fe+H2SO4═H2↑+FeSO4计算.
解答 解:加热条件下,Fe与浓硫酸反应生成二氧化硫,当硫酸浓度减小,变为稀硫酸时,生成氢气,检验二氧化硫用品红溶液,生成的氢气与CuO反应生成水蒸气,通过检验水蒸气的存在,可以证明生成了氢气,所以D装置要干燥氢气,F装置为无水硫酸铜检验水蒸气,G装置是为了防止空气中的水蒸气产生干扰;
(1)由装置图可知,仪器G的名称是干燥管;F装置为无水硫酸铜检验水蒸气,G装置干燥管中是干燥剂,可以吸收空气中的水蒸气,防止空气中的水蒸气进入F产生干扰;
故答案为:干燥管;防止空气中的水进入F装置;
(2)浓硫酸变为稀硫酸时,与Fe反应生成氢气,其反应的方程式为:Fe+H2SO4═H2↑+FeSO4;
故答案为:Fe+H2SO4═H2↑+FeSO4;
(3)D中药品是用来干燥氢气,D中药品为液体干燥剂,所以D中为浓硫酸;CuO与氢气反应生成水蒸气,水蒸气进入F中使无水硫酸铜变蓝色;
故答案为:浓硫酸;检验水的生成;
(4)E转化固体为CuO,在加热条件下,CuO与氢气反应生成Cu,所以现象为黑色固体变红;
故答案为:黑色固体变红;
(5)若A中反应后铁有剩余,则溶液转化Fe为Fe2+,Fe2+在空气中能被氧气氧化为Fe3+,所得溶液久置于空气中会生成红褐色絮状物,即生成了氢氧化铁沉淀,所以反应的离子方程式为:12Fe2++3O2+6H2O═4Fe(OH)3↓+8Fe3+;
故答案为:12Fe2++3O2+6H2O═4Fe(OH)3↓+8Fe3+;
(6)测得反应前后E装置的质量减少了0.32g,则n(O)=$\frac{0.32g}{16g/mol}$=0.02mol,则(H2)=0.02mol,由Fe+H2SO4═H2↑+FeSO4,可知消耗硫酸为0.02mol,所以发生Fe+2H2SO4═SO2↑+FeSO4+H2O的硫酸为0.18-0.02=0.16mol,所以FeSO4为0.16mol×$\frac{1}{2}$+0.02mol=0.1mol,所以FeSO4溶液物质的量浓度为10mol/L;
故答案为:10.
点评 本题考查了了浓硫酸的化学性质,题目难度中等,注意掌握Fe与浓硫酸的反应原理及氢气的检验方法,试题侧重基础知识的考查,有利于提高学生灵活应用基础知识的能力.

 阅读快车系列答案
阅读快车系列答案 柠檬酸(C6H8O7)是一种工业原料,广泛应用于食品、医药等行业.下图是两种不同方法制备一水柠檬酸晶体(C6H8O7•H2O)的工艺流程图.回答相关问题:
柠檬酸(C6H8O7)是一种工业原料,广泛应用于食品、医药等行业.下图是两种不同方法制备一水柠檬酸晶体(C6H8O7•H2O)的工艺流程图.回答相关问题:【资料卡片】
①柠檬酸水溶液显酸性,柠檬酸钙不溶于水;
②工业生产柠檬酸,原料预处理后,得到的发酵液中
含有柠檬酸及其他可溶性杂质;
③一水柠檬酸在不同温度下的溶解度如下表:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | … |
| 溶解度/g | 96 | 118 | 146 | 183 | 216 | … |
【钙盐法制备】
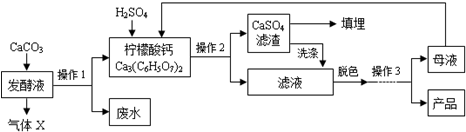
(1)气体X是CO2(填化学式),实验室检验该气体的化学方程式为CO2+Ca(OH)2═CaCO3↓+H20;
(2)操作1、2的名称是过滤;
(3)操作3的目的是得到一水柠檬酸晶体,操作顺序是b→c→a;(填序号)
a.过滤 b.加热浓缩 c.冷却结晶 d.蒸发结晶
(4)工业生产中,可加入A(填序号)进行脱色处理;
A.活性炭 B.明矾 C.肥皂水
(5)洗涤CaSO4滤渣的目的是提高产量;
(6)母液可以循环,其中一定含有的溶质是柠檬酸.
| 甲 | 乙 | |||
| 起始浓度 | 5min时浓度 | 起始浓度 | 5min时浓度 | |
| c(CO)/mol/L | 0.1 | 0.08 | 0.2 | x |
| c(H2O)/mol/L | 0.1 | 0.08 | 0.2 | y |
| A. | x=y=0.16 | |
| B. | 反应开始时,乙中反应速率比甲快 | |
| C. | 甲中0~5min的平均反应速率:v(CO)=0.004 mol/(L•min) | |
| D. | 平衡时,乙中H2O的转化率是50%,c(CO)是甲中的2倍 |
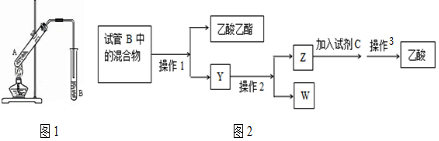
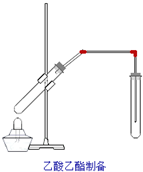 如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验
如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验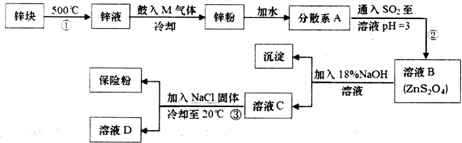
 .分散系A为悬浊液(填“溶液”“胶体”或“悬浊液”).
.分散系A为悬浊液(填“溶液”“胶体”或“悬浊液”).