题目内容
 A、B为充满KOH溶液的两只试管.切断K1,合闭K2、K3,通直流电,电解一段时间后A、B中均有气体产生.装置如图.回答下列问题:
A、B为充满KOH溶液的两只试管.切断K1,合闭K2、K3,通直流电,电解一段时间后A、B中均有气体产生.装置如图.回答下列问题:(1)电源的a极为
(2)在湿的Na2SO4滤纸条中心滴KMnO4溶液,紫色向
(3)写出A中的电极反应式:
(4)若电解一段时间后,A和B中均有气体包围电极.此时切断K2和K3,闭合K1,则电流表的指针移动,原因
考点:原电池和电解池的工作原理
专题:电化学专题
分析:在A、B中充满KOH溶液后倒立于盛有KOH溶液的水槽中,再分别插入一多孔的惰性电极.切断K1,闭合K2、K3通直流电,为电解池装置,因为B试管中气体体积是A试管中的2倍,所以B中为H2,A中为O2,即B为阴极,A为阳极,所以b为正极,a为负极;电解时,阴离子向阳极移动,阳离子向阴极移动;电解氢氧化钾溶液时,阳极发生氧化反应,电极方程式为4OH-4e-=2H2O+O2↑,切断K2、K3,合闭K1,电解一段时间后,由A中的O2,B中的H2与KOH溶液形成H2-O2燃料电池.
解答:
解:(1)切断K1,合闭K2、K3通直流电,电极A、B及氢氧化钾溶液构成电解池,根据离子的放电顺序,溶液中氢离子、氢氧根离子放电,分别生成氢气和氧气,氢气和氧气的体积比为2:1,通过图象知,B极上气体体积是A极上气体体积的2倍,所以B极上得氢气,A极上得到氧气,所以B极是阴极,A极是阳极,故a是负极,b是正极.
故答案为:负;
(2)浸有硫酸钠的滤纸和电极C、D与电源也构成了电解池,因为a是负极,b是正极,所以C是阴极,D是阳极,电解质溶液中的阳离子钾离子向阴极移动,阴离子高锰酸根离子向阳极移动,所以D极呈紫色,
故答案为:D;
(3)A极上氢氧根离子失电子生成氧气和水,电极反应式为4OH--4e-═2H2O+O2↑,故答案为:4OH-4e-=2H2O+O2↑;
(4)切断K2、K3,合闭K1,电解一段时间后,A、B中均有气体包围电极.此装置构成氢氧燃料原电池,所以有电流通过,电流表的指针移动,
故答案为:组成氢氧燃料电池.
故答案为:负;
(2)浸有硫酸钠的滤纸和电极C、D与电源也构成了电解池,因为a是负极,b是正极,所以C是阴极,D是阳极,电解质溶液中的阳离子钾离子向阴极移动,阴离子高锰酸根离子向阳极移动,所以D极呈紫色,
故答案为:D;
(3)A极上氢氧根离子失电子生成氧气和水,电极反应式为4OH--4e-═2H2O+O2↑,故答案为:4OH-4e-=2H2O+O2↑;
(4)切断K2、K3,合闭K1,电解一段时间后,A、B中均有气体包围电极.此装置构成氢氧燃料原电池,所以有电流通过,电流表的指针移动,
故答案为:组成氢氧燃料电池.
点评:该题综合考查原电池和电解池知识,是高考中的常见题型和重要的考点之一,属于中等难度的试题.试题综合性强,难易适中,贴近高考,有利于培养学生分析问题、解决问题的能力,也有助于培养学生的逻辑思维能力和发散思维能力,提高学生学习效率.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列离子方程式书写正确的是( )
| A、铵明矾[NH4Al(SO4)2?12H2O]溶液中加入过量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| B、H218O中投入Na2O2固体:2H218O+2Na2O2=4Na++4OH-+18O2↑ |
| C、碳酸氢钙溶液中加过量澄清石灰水:Ca2++OH-+HCO3-=CaCO3↓+H2O |
| D、碳酸钠的水解反应:CO32-+H3O+?HCO3-+H2O |
在密闭容器中,反应X2(g)+Y2(g)?2XY(g)△H<0,达到甲平衡.在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )


| A、图Ⅰ是加入适当催化剂的变化情况 |
| B、图Ⅱ是扩大容器体积的变化情况 |
| C、图Ⅲ是升高温度的变化情况 |
| D、图Ⅲ是增大压强的变化情况 |
某温度下,在容积可变的容器中,反应2A(g)+B(g)?2C(g)达到平衡时,A、B和C的物质的量分别为6mol、3mol和6mol.保持温度和压强不变,对平衡混合物中三者的物质的量作如下调整,可使平衡右移的是
( )
( )
| A、均减半 |
| B、均加倍 |
| C、均增加2mol |
| D、均减少2mol |
图示原电池工作时,叙述正确的是( )
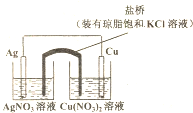

| A、在外电路中,电子由银电极流向铜电极 |
| B、正极反应为:Ag++e-=Ag |
| C、实验过程中取出盐桥,原电池仍能继续工作 |
| D、盐桥中的K+移向Cu(NO3)2溶液 |
2013 年进入冬季以来,中国多个城市出现雾霾天气,下列现象不会加剧雾霾形成的是( )
| A、火力发电厂燃烧大量的煤 |
| B、森林火灾 |
| C、城市大量的汽车行驶 |
| D、大气中的闪电 |


 (1)某反应过程中的能量变化如图所示:写出该反应的热化学方程式
(1)某反应过程中的能量变化如图所示:写出该反应的热化学方程式