题目内容
4.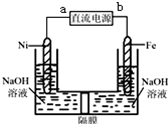 Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其电解制法如图所示,请根据图示分析:电解过程中的电池反应为Fe+2OH-+2H2O $\frac{\underline{\;电解\;}}{\;}$FeO42-+3H2↑;每转移0.6mol电子在Ni电极上产生的气体在标况下的体积为6.72L;隔膜用阳离子交换膜(只允许阳离子通过)还是阴离子交换膜(只允许阴离子通过)阳离子交换膜.
Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其电解制法如图所示,请根据图示分析:电解过程中的电池反应为Fe+2OH-+2H2O $\frac{\underline{\;电解\;}}{\;}$FeO42-+3H2↑;每转移0.6mol电子在Ni电极上产生的气体在标况下的体积为6.72L;隔膜用阳离子交换膜(只允许阳离子通过)还是阴离子交换膜(只允许阴离子通过)阳离子交换膜.
分析 利用电解法制备Na2FeO4,Fe作阳极,碱性条件下Fe失电子转化为FeO42-离子,阳极电极反应式为:Fe+8OH--6e-=FeO42-+4H2O,Ni为阴极,发生还原反应,氢离子放电生成氢气,阴极电极反应式为:6H2O+6e-=3H2↑+6OH-,FeO42-离子氧化性很强,容易在阴极被还原,需要用用阳离子交换膜,防止生成的FeO42-离子在阴极被还原;
根据电子转移守恒,计算生成氢气的物质的量,再根据V=nVm计算氢气体积.
解答 解:利用电解法制备Na2FeO4,Fe作阳极,碱性条件下Fe失电子转化为FeO42-离子,阳极电极反应式为:Fe+8OH--6e-=FeO42-+4H2O,Ni为阴极,发生还原反应,氢离子放电生成氢气,阴极电极反应式为:6H2O+6e-=3H2↑+6OH-,所以电池反应式为:Fe+2OH-+2H2O $\frac{\underline{\;电解\;}}{\;}$FeO42-+3H2↑;
根据电子转移守恒,生成氢气的物质的量为$\frac{0.6mol}{2}$=0.3mol,标况下氢气体积为0.3mol×22.4L/mol=6.72L;
FeO42-离子氧化性很强,容易在阴极被还原,需要用用阳离子交换膜,防止生成的FeO42-离子在阴极被还原,
故答案为:Fe+2OH-+2H2O $\frac{\underline{\;电解\;}}{\;}$FeO42-+3H2↑;6.72L;阳离子交换膜.
点评 本题考查电解原理应用,根据装置图判断两极,结合高铁酸钠具有强氧化性分析,侧重考查学生知识迁移应用,是对学生综合能力的考查,难度中等.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
14.下列有关叙述正确的是( )
| A. | 稀硝酸和氢氧化亚铁反应的离子方程式:Fe(OH)2+2H+═Fe2++2H2O | |
| B. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| C. | 在酸性溶液中,Na+、K+、MnO4-、Br-能大量共存 | |
| D. | 除去Mg2+溶液中的少量Al3+,可以采用加入足量的氢氧化钠后过滤、再加酸的方法 |
11.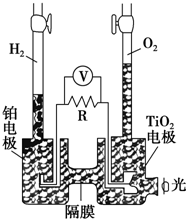 TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图,电解质溶液为稀硫酸.下列叙述正确的是( )
TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图,电解质溶液为稀硫酸.下列叙述正确的是( )
 TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图,电解质溶液为稀硫酸.下列叙述正确的是( )
TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图,电解质溶液为稀硫酸.下列叙述正确的是( )| A. | 该装置只能将光能转化为电能 | |
| B. | TiO2电极上发生的反应为:2H++2e-═H2↑ | |
| C. | 该装置工作时,电流由TiO2电极经R流向铂电极 | |
| D. | 该装置工作时,TiO2电极附近溶液的pH变小 |

 (R、R′代表烃基)
(R、R′代表烃基) .
. 的同分异构体中满足下列条件的共有5种,其中核磁共振氢谱有4组峰,且峰面积之比为1:1:1:2的是
的同分异构体中满足下列条件的共有5种,其中核磁共振氢谱有4组峰,且峰面积之比为1:1:1:2的是 (填结构简式).
(填结构简式).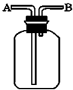 现有六种气体:H2、O2、NH3、SO2、NO2、NO.可以利用如图所示装置进行收集.
现有六种气体:H2、O2、NH3、SO2、NO2、NO.可以利用如图所示装置进行收集.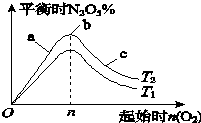 某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应4NO2(g)+O2(g)?2N2O5(g)△H<0的影响.
某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应4NO2(g)+O2(g)?2N2O5(g)△H<0的影响.