题目内容
常温下,下列各组离子在指定环境下能大量共存的是( )
| A、pH=7的溶液中Al3+、Cl-、SO42-、HCO3- |
| B、由水电离出来的c(H+)=10-12mol/L的溶液中Na+、HCO3-、SO42-、K+ |
| C、pH=0的溶液中Na+、K+、Fe2+、ClO- |
| D、c(OH-)=10-2mol/L的溶液中S2-、SO42-、S2O32-、Na+ |
考点:离子共存问题
专题:离子反应专题
分析:A.发生互促水解反应的离子不能大量共存;
B.由水电离出来的c(H+)=10-12mol/L的溶液,水的电离受到抑制,溶液可能呈酸性,也可能呈碱性;
C.pH=0的溶液呈酸性;
D.c(OH-)=10-2mol/L的溶液呈碱性.
B.由水电离出来的c(H+)=10-12mol/L的溶液,水的电离受到抑制,溶液可能呈酸性,也可能呈碱性;
C.pH=0的溶液呈酸性;
D.c(OH-)=10-2mol/L的溶液呈碱性.
解答:
解:A.Al3+、HCO3-发生互促水解反应,不能大量共存,故A错误;
B.由水电离出来的c(H+)=10-12mol/L的溶液,水的电离受到抑制,溶液可能呈酸性,也可能呈碱性,无论呈酸性还是碱性,HCO3-都不能大量共存,故B错误;
C.pH=0的溶液呈酸性,酸性条件下,Fe2+、ClO-发生氧化还原反应,故C错误;
D.c(OH-)=10-2mol/L的溶液呈碱性,碱性条件下,离子之间不发生任何反应,可大量共存,故D正确.
故选D.
B.由水电离出来的c(H+)=10-12mol/L的溶液,水的电离受到抑制,溶液可能呈酸性,也可能呈碱性,无论呈酸性还是碱性,HCO3-都不能大量共存,故B错误;
C.pH=0的溶液呈酸性,酸性条件下,Fe2+、ClO-发生氧化还原反应,故C错误;
D.c(OH-)=10-2mol/L的溶液呈碱性,碱性条件下,离子之间不发生任何反应,可大量共存,故D正确.
故选D.
点评:本题考查离子共存,为高考常见题型,侧重于元素化合物的综合考查和学生的分析能力的考查,注意离子之间发生氧化还原反应以及互促水解反应的特点,答题时注意审题,把握题给要求,为解答该题的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
对于某些离子的检验及结论一定正确的是( )
| A、焰色反应为黄色,则该物质一定为钠的化合物 |
| B、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
| C、加入稀盐酸酸化的氯化钡溶液有白色沉淀产生,则一定含有SO42- |
| D、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL4.40mol/L盐酸中,充分反应后产生896mLH2(标准状况),残留固体1.28g.过滤,滤液中无Cu2+,将滤液加水稀释到200mL,测得其中c(H+)为0.40mol/L.则原混合物中氧化铁的质量是( )
| A、2.4g | B、3.6g |
| C、5.6g | D、6.4g |
在恒温恒容条件下,能使A(g)+2B(s)?C(g)+3D(g)的正反应速率增大的措施是( )
| A、减小C的浓度 |
| B、增大B的量 |
| C、减小D的浓度 |
| D、增大A的量 |
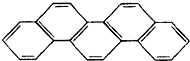 有一种有机物,因其酷似奥林匹克旗中的五环(如图),科学家称其为奥林匹克烃,下列有关奥林匹克烃的说法正确的是( )
有一种有机物,因其酷似奥林匹克旗中的五环(如图),科学家称其为奥林匹克烃,下列有关奥林匹克烃的说法正确的是( )| A、该烃属于烯烃 |
| B、该烃分子中只含非极性键 |
| C、该烃的二氯代物只有一种 |
| D、该烃完全燃烧生成H2O的物质的量小于CO2的物质的量 |
已知Kφ(AgCl)=1.8×10-10mol2?L-2,Kφ(AgBr)=5.0×10-13mol2?L-2,Kφ(Ag2CrO4)=9.0×10-12mol2?L-3.某溶液中含有Cl-、Br-和CrO42-,浓度均为0.10mol?L-1,向该溶液中逐滴加入0.10mol?L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
| A、Cl-、Br-、CrO42- |
| B、CrO42-、Br-、Cl- |
| C、Br-、Cl-、CrO42- |
| D、Br-、CrO42-、Cl- |
某温度下,浓度都为1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z.反应2min后,测得 X2的浓度为0.4mol/L,用Y2的变化表示的反应速率v(Y2)=0.1mol/(L?min),生成的c(Z)=0.4mol/L,如z用X、Y表示,则该反应方程式是( )
| A、X2+2Y2═2XY2 |
| B、2X2+Y2═2X2Y |
| C、3X2+Y2═2X3Y |
| D、X2+3Y2═2XY3 |
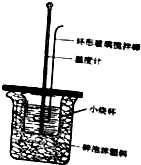 某学习小组制作如图所示简易量热计测定中和反应的反应热,烧杯中,并用温度计测量盐酸的温度;用另一个量筒量取50mL筒中的NaOH溶液一次倒入小烧杯,盖好插有温度计和环形搅拌棒的盖板,匀速搅拌,记录溶液到达的最高温度.
某学习小组制作如图所示简易量热计测定中和反应的反应热,烧杯中,并用温度计测量盐酸的温度;用另一个量筒量取50mL筒中的NaOH溶液一次倒入小烧杯,盖好插有温度计和环形搅拌棒的盖板,匀速搅拌,记录溶液到达的最高温度.