题目内容
14.某元素R的氯化物为RCl2,将1.90gRCl2完全溶于水制成溶液,向其中加入40mL1mol/L的AgNO3溶液恰好完全反应.若该元素的原子中质子数与中子数相等,请计算:(1)元素R的相对原子质量;
(2)元素R在元素周期表中的位置.
分析 RCl2与AgNO3发生:RCl2+2AgNO3═2AgCl↓+R(NO3)2,n(AgNO3)=0.04L×1mol/L=0.04mol,则n(RCl2)=0.02mol,根据M=$\frac{m}{M}$计算Cl2R的相对分子质量,可得R的相对原子质量,再根据质量数=质子数+中子数计算质子数,确定元素的种类,判断在周期表中的位置.
解答 解:(1)n(AgNO3)=0.04L×1mol/L=0.04mol,则:
RCl2+2AgNO3═2AgCl↓+R(NO3)2,
1 2
0.02mol 0.04mol
M(RCl2)=$\frac{1.90g}{0.02mol}$=95g/mol,
Mr(X)=95-2×35.5g=24
答:R元素相对原子质量为24;
(2)R的相对原子质量为24,近似等于质量数,所以质量数为24,故质子数=$\frac{24}{2}$=12,为Mg元素,位于周期表第三周期第ⅡA,
答:R元素在周期表中位于第三周期第ⅡA.
点评 本题考查化学方程式计算、结构与位置关系等,关键是根据反应的关系式计算R的相对分子质量,根据原子的构成和确定元素的种类.

练习册系列答案
相关题目
4.盒中放有等质量的镁片和铝片各2片,甲、乙、丙、丁四名同学分别抽出一片,与同浓度等体积的足量盐酸反应,经过室验分析发现,甲抽出的金属片与盐酸反应放出H2较慢,乙抽出的金属片与盐酸反应放出H2较多,则甲、乙抽出的金属片分别为( )
| A. | Mg、Mg | B. | Mg、Al | C. | Al、Mg | D. | Al、Al |
2.下列实验操作对应的实验现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 某钾盐晶体中滴入浓盐酸,产生的气体通入品红溶液 | 品红溶液褪色 | 产生的气体一定是SO2 |
| B | 用磁铁吸引氧化铁与铝粉发生铝热反应后的黑色产物 | 能被磁铁吸引 | 黑色熔化物中含铁、四氧化三铁中的1种或2种 |
| C | 向某硫酸盐溶液中滴入酸性H2O2溶液,再滴入KSCN溶液 | 溶液变为红色 | 该硫酸盐一定为FeSO4 |
| D | 某品牌加碘食盐的溶液中,加入淀粉,并通入NO2 | 溶液变为蓝色 | 该加碘食盐中碘的存在形式为IO3- |
| A. | A | B. | B | C. | C | D. | D |
19.在一定条件下,可以用如图(1)所示的硼化钒(VB2)-空气电池气(工作时反应为:4VB2+11O2=4B2O3+2V2O5)为电源给图(2)所示装置通电,模拟有机物的电化学储氢.下列说法正确的是( )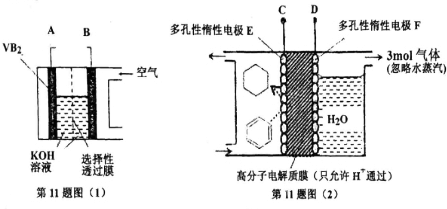

| A. | 整套装置工作时的连接为A连接D、B连接C | |
| B. | VB2极发生的电极反应为:2VB2+22OH--22e-=V2O5+2B2O3+11H2O | |
| C. | 电极F产生3mol气体时电极E得到的氧化产物为2mol | |
| D. | 储氢装置工作时,右侧电极区的pH值减小 |
6. CaCO3与稀盐酸反应(放热反应),CaCO3+2HCl=CaCl2+CO2↑+H2O,生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )
CaCO3与稀盐酸反应(放热反应),CaCO3+2HCl=CaCl2+CO2↑+H2O,生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )
 CaCO3与稀盐酸反应(放热反应),CaCO3+2HCl=CaCl2+CO2↑+H2O,生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )
CaCO3与稀盐酸反应(放热反应),CaCO3+2HCl=CaCl2+CO2↑+H2O,生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )| A. | 反应开始2min内平均反应速率最大 | |
| B. | 可用c(Ca2+)或c(H+)的变化表示该反应速率 | |
| C. | 反应4min后平均反应速率减小 | |
| D. | 反应在第2min到第4min间生成CO2的平均反应速率为v${\;}_{C{O}_{2}}$=0.1mol/min |
18.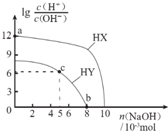 常温下,浓度均为0.1mol?L-1、体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg$\frac{c({H}^{+})}{c(O{H}^{-})}$随加入NaOH的物质的量的变化如图所示.下列叙述正确的是( )
常温下,浓度均为0.1mol?L-1、体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg$\frac{c({H}^{+})}{c(O{H}^{-})}$随加入NaOH的物质的量的变化如图所示.下列叙述正确的是( )
 常温下,浓度均为0.1mol?L-1、体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg$\frac{c({H}^{+})}{c(O{H}^{-})}$随加入NaOH的物质的量的变化如图所示.下列叙述正确的是( )
常温下,浓度均为0.1mol?L-1、体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg$\frac{c({H}^{+})}{c(O{H}^{-})}$随加入NaOH的物质的量的变化如图所示.下列叙述正确的是( )| A. | HX的酸性弱于HY | |
| B. | a点由水电离出的c(H+)=10-12 mol?L-1 | |
| C. | c点溶液中:c(Y-)>c(HY) | |
| D. | b点时酸碱恰好完全反应 |
 .
. .
.