题目内容
14.下列实验设计方案合理且能达到实验目的是( )| 选项 | A | B | C | D |
| 实验目的 | 验证HCl水溶液的酸性 | 检验葡萄糖的醛基 | 配制一定质量分数的AlCl3水溶液 | 测定中和反应的反应热 |
| 实验方案设计 |  |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
分析 A.HCl极易溶于水,应该使用防倒吸装置;
B.该反应需要在碱性条件下进行,加入的氢氧化钠溶液应该过量;
C.铝离子易水解,应加入少量稀盐酸抑制铝离子水解;
D.缺少搅拌仪器-环形玻璃搅拌棒.
解答 解:A.氯化氢极易溶于水,该装置中易发生倒吸现象,应该采用防倒吸装置,故A错误;
B.醛与氢氧化铜浊液的反应需要在碱性条件下进行,配制氢氧化铜浊液时应该加入过量氢氧化钠溶液,故B错误;
C.配制一定质量分数的AlCl3水溶液时,为了抑制铝离子水解,需要加入少量稀盐酸,图示侧重合理,故C正确;
D.中和热测定中需要用环形玻璃搅拌棒搅拌,图示装置中缺少环形玻璃搅拌棒,故D错误;
故选C.
点评 本题考查化学实验方案的评价,题目难度不大,涉及盐的水解原理应用、中和热测定、物质检验等知识,明确常见化学实验基本操作方法即可解答,试题侧重基础知识的考查,培养了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
4.有温度、容积相同的甲、乙两个密闭容器.往甲容器中通入1g N2和1g H2,乙容器中通入2g N2和2g H2,保持恒温、恒容达到平衡,相关参数比较正确的是( )
| A. | 平衡时N2的转化率:α甲>2α乙 | B. | 平衡时NH3的浓度:2c甲<c乙 | ||
| C. | 平衡时体系压强:2p甲>p乙 | D. | 反应放出的热量:2Q甲>Q乙 |
5.用惰性电极电解FeSO4溶液制备高纯铁的原理如图所示.下列说法错误的是( )
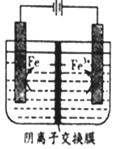

| A. | .阳极主要发生反应:Fe2+-e-═Fe3+ | |
| B. | 可用高纯铁电极作阴扱 | |
| C. | .电解液中的SO42-由右向左通过阴离子交换膜 | |
| D. | .电解法制备髙纯铁总反应:3Fe2+$\frac{\underline{\;通电\;}}{\;}$Fe+2Fe3+ |
9.二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,答下列问題:
(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为2:1;
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:

①电解时发生反应的化学方程式为NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑;
②设计实验来确定溶液X的成份,请补充完成实验步骤和现象
③除去ClO2中的NH3可选用的试剂是c(填标号);
a.水b.碱石灰c.浓硫酸d.饱和食盐水
(3)O2处理过的饮用水会含有一定量的亚氯酸盐.若要除去超标的亚氯酸盐,下列物质最适宜的是d填标号).
a.明矾 b.碘化钾 c.盐酸d.硫酸亚铁.
(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为2:1;
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:

①电解时发生反应的化学方程式为NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑;
②设计实验来确定溶液X的成份,请补充完成实验步骤和现象
| 实验步骤 | 实验现象 | 实验结论 |
| I:取一根铂丝在火焰上灼烧至无色,再蘸取少许溶液X在火焰上烧 | 溶液X中含有钠离子 | |
| II:取少许溶液X于一支试管中,滴加先滴加硝酸,再滴加硝酸银溶液(或滴加硝酸酸化的硝酸银溶液), | 溶液X中含有氯离子 |
a.水b.碱石灰c.浓硫酸d.饱和食盐水
(3)O2处理过的饮用水会含有一定量的亚氯酸盐.若要除去超标的亚氯酸盐,下列物质最适宜的是d填标号).
a.明矾 b.碘化钾 c.盐酸d.硫酸亚铁.
19.下列实验方案能达到实验目的是( )
| A. | 用苯和饱和溴水制溴苯 | |
| B. | 用浓盐酸和铁粉制少量氢气 | |
| C. | 用NaOH溶液除去MgC12溶液中的AlC13杂质 | |
| D. | 用右图所示装置制备乙酸乙酯 |
6. 将不可再生的天然气、石油、煤等化石燃料转化利用、提高利用率已成为当务之急.
将不可再生的天然气、石油、煤等化石燃料转化利用、提高利用率已成为当务之急.
(1)根据部分键能数据和CH4 (g)+4F2 (g)=CF4(g)+4HF(g)的反应热△H为1940kJ•mol-1,计算H-F键的键能为565kJ•mol-1.
(2)甲醇、二甲醚(CH3OCH3)被称为21世纪的新型燃料,二者均可利用CO和H2反应合成.
①某燃料电池以二甲醚为原料,熔融碳酸盐为电解质,其负极反应如下:CH3OCH3+6CO32--12e-═8CO2+3H2O.写出该燃料电池的正极反应式O2+4e-+2CO2=2CO32-;.
②废水中含甲醇对水质会造成污染,Co3+可将甲醇氧化为CO2.某同学以Pt作电极电解酸性含甲醇废水与CoSO4混合液模拟工业除污原理,其阳极反应式Co2+-e-=Co3+.
(3)某企业采用如图所示原理处理化石燃料开采、加工过程产生H2S废气.
①电解池中电极A、B均为惰性电极,其中A为电解池的阳极;电极B所得到的物质X的分子式为H2.
②反应池中发生的离子反应方程式为H2S+2Fe3+=2Fe2++S↓+2H+.
 将不可再生的天然气、石油、煤等化石燃料转化利用、提高利用率已成为当务之急.
将不可再生的天然气、石油、煤等化石燃料转化利用、提高利用率已成为当务之急.(1)根据部分键能数据和CH4 (g)+4F2 (g)=CF4(g)+4HF(g)的反应热△H为1940kJ•mol-1,计算H-F键的键能为565kJ•mol-1.
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ.mol-1) | 414 | 489 | ? | 155 |
①某燃料电池以二甲醚为原料,熔融碳酸盐为电解质,其负极反应如下:CH3OCH3+6CO32--12e-═8CO2+3H2O.写出该燃料电池的正极反应式O2+4e-+2CO2=2CO32-;.
②废水中含甲醇对水质会造成污染,Co3+可将甲醇氧化为CO2.某同学以Pt作电极电解酸性含甲醇废水与CoSO4混合液模拟工业除污原理,其阳极反应式Co2+-e-=Co3+.
(3)某企业采用如图所示原理处理化石燃料开采、加工过程产生H2S废气.
①电解池中电极A、B均为惰性电极,其中A为电解池的阳极;电极B所得到的物质X的分子式为H2.
②反应池中发生的离子反应方程式为H2S+2Fe3+=2Fe2++S↓+2H+.
 ,该分子中含有官能团的名称是羟基、羧基、羰基和碳碳双键,该分子不能发生消去反应(填“能”或者“不能”).二噁英是一类物质的统称,这类物质的母体结构为
,该分子中含有官能团的名称是羟基、羧基、羰基和碳碳双键,该分子不能发生消去反应(填“能”或者“不能”).二噁英是一类物质的统称,这类物质的母体结构为 ,其中苯环上的氢原子如果被氯原子取代,所得到的物质毒性是KCN的100倍.该分子中含有官能团的名称是氯原子、醚键.
,其中苯环上的氢原子如果被氯原子取代,所得到的物质毒性是KCN的100倍.该分子中含有官能团的名称是氯原子、醚键. .
.