题目内容
10.工业上利用氨氧化获得的高浓度NOx气体(含NO、NO2)制备NaNO2、NaNO3,工艺流程如下:
已知:Na2CO3+NO+NO2═2NaNO2+CO2
(1)中和液所含溶质除NaNO2及少量Na2CO3外,还有NaNO3(填化学式).
(2)中和液进行蒸发Ⅰ操作时,应控制水的蒸发量,避免浓度过大,目的是防止NaNO2的析出.蒸发Ⅰ产生的蒸汽中含有少量NaNO2等有毒物质,不能直接排放,将其冷凝后用于流程中的溶碱(填操作名称)最合理.
(3)母液Ⅰ进行转化时加入稀HNO3的目的是将NaNO2转化为NaNO3.母液Ⅱ需回收利用,下列处理方法合理的是cd.
a.转入中和液 b.转入结晶Ⅰ操作
c.转入转化液 d.转入结晶Ⅱ操作
(4)工业上可用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,反应原理为Ca(OH)2+NO+NO2═Ca(NO2)2+H2O.
①若n(NO):n(NO2)>1:1,则会导致排放气体中NO含量升高,污染环境;
②若n(NO):n(NO2)<1:1,则会导致产品Ca(NO2)2中Ca(NO3)2含量升高.
(5)若将NaNO2、NaNO3两种产品的物质的量之比设为2:1,则生产1.38t NaNO2时,Na2CO3的理论用量为1.59t(假设Na2CO3恰好完全反应).
分析 由制备流程可知,碳酸钠溶解后,碱吸收发生Na2CO3+NO+NO2═2NaNO2+CO2、3NO2+H2O=HNO3+NO、Na2CO3+2HNO3=NaNO3+H2O+CO2↑,然后中和液进行蒸发Ⅰ操作,应避免浓度过大NaNO2析出,蒸发Ⅰ产生的蒸汽中含有少量的NaNO2等有毒物质要回收再循环利用;结晶过滤分离出NaNO3,母液I中主要含NaNO2,母液Ⅰ进行转化时加入稀HNO3、空气,硝酸提供酸性环境,可将NaNO2转化为NaNO3,转化液蒸发、结晶、过滤分离出NaNO3,母液Ⅱ中主要含NaNO3,以此解答该题.
解答 解:(1)由制备流程可知,碳酸钠溶解后,碱吸收发生Na2CO3+NO+NO2═2NaNO2+CO2、3NO2+H2O=HNO3+NO、Na2CO3+2HNO3=NaNO3+H2O+CO2↑,所以中和液所含溶质除NaNO2及少量Na2CO3外,还有NaNO3,
故答案为:NaNO3;
(2)中和液进行蒸发Ⅰ操作时,应控制水的蒸发量,避免浓度过大,目的是防止NaNO2的析出,蒸发Ⅰ产生的蒸汽中含有少量的NaNO2等有毒物质,不能直接排放,将其冷凝后用于流程中的溶碱,循环利用,提高利用率,
故答案为:防止NaNO2的析出;溶碱;
(3)由上述分析可知,结晶过滤分离出NaNO3,母液I中主要含NaNO2,进行转化时加入稀HNO3的目的是将NaNO2转化为NaNO3,母液Ⅱ需回收利用,可转入转化液或转入结晶Ⅱ操作,提高其利用率,
故答案为:将NaNO2转化为NaNO3;cd;
(4)①若n(NO):n(NO2)>1:1,则一氧化氮过量,排放气体中NO含量升高,污染环境,故答案为:排放气体中NO含量升高,污染环境;
②若n(NO):n(NO2)<1:1,则二氧化氮过量,二氧化氮可与石灰乳反应生成Ca(NO3)2,
故答案为:产品Ca(NO2)2中Ca(NO3)2含量升高;
(5)生产1.38吨NaNO2时,n(NaNO2)=$\frac{1.38×1{0}^{6}g}{69g/mol}$=2×104mol,NaNO2、NaNO3两种产品的物质的量之比为2:1,则n(NaNO3)=1×104mol,由Na原子守恒可知,2n(Na2CO3)=n(NaNO2)+n(NaNO3),m(Na2CO3)=(2×104mol+1×104mol)×$\frac{1}{2}$×106g/mol=1.59×106g=1.59t,
故答案为:1.59.
点评 本题考查工业制备NaNO2、NaNO3,为高考常见题型,题目涉及物质的制备流程及混合物分离提纯综合应用,把握流程中的反应、分离方法为解答的关键,注意工业生产与环境保护、原料利用率等,侧重分析与应用能力的综合考查,题目难度中等.

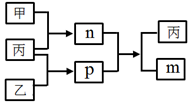 短周期主族元素A、B、C、D的原子序数依次增大,C和D位于同一主族.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为淡黄色固体,易溶在BD2中,p的水溶液是一种二元弱酸,有漂白性.上述物质的转化关系如图所示(反应条件省略).下列说法正确的是( )
短周期主族元素A、B、C、D的原子序数依次增大,C和D位于同一主族.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为淡黄色固体,易溶在BD2中,p的水溶液是一种二元弱酸,有漂白性.上述物质的转化关系如图所示(反应条件省略).下列说法正确的是( )| A. | 原子半径:A<B<C | |
| B. | BD2分子中所有原子都达到了8电子稳定结构 | |
| C. | C与D的简单氢化物沸点,后者高 | |
| D. | 非金属性:D>C>B |
| A. |  | B. |  | C. |  | D. |  |
 在通电条件下,用如图所示装置由乙二醛(OHC-CHO)反应制备乙二酸(HOOC-COOH).其制备反应为:OHC-CHO+2Cl2+2H2O→HOOC-COOH+4HCl.下列说法正确的是( )
在通电条件下,用如图所示装置由乙二醛(OHC-CHO)反应制备乙二酸(HOOC-COOH).其制备反应为:OHC-CHO+2Cl2+2H2O→HOOC-COOH+4HCl.下列说法正确的是( )| A. | 每消耗0.lmol乙二醛,在Pt1极放出2.24L气体(标准状况) | |
| B. | Pt1的电极反应为:4OH--4e-=2H2O+O2↑ | |
| C. | 每得到1mol乙二酸将有2molH+从右室迁移到左室 | |
| D. | 盐酸是起提供Cl-和增强导电性的作用 |

| A. | .阳极主要发生反应:Fe2+-e-═Fe3+ | |
| B. | 可用高纯铁电极作阴扱 | |
| C. | .电解液中的SO42-由右向左通过阴离子交换膜 | |
| D. | .电解法制备髙纯铁总反应:3Fe2+$\frac{\underline{\;通电\;}}{\;}$Fe+2Fe3+ |
 化学镀的原理是利用化学反应生成金属单质沉淀在镀件表面形成的镀层.某化学镀铜的反应速率随镀液 pH 变化如图所示.(已知:该镀铜过程中,镀液 pH 控制在 12.5 左右).根据图中信息,下列说法正确的是( )
化学镀的原理是利用化学反应生成金属单质沉淀在镀件表面形成的镀层.某化学镀铜的反应速率随镀液 pH 变化如图所示.(已知:该镀铜过程中,镀液 pH 控制在 12.5 左右).根据图中信息,下列说法正确的是( )| A. | 若采用电镀的方法,镀件应与电源正极连接 | |
| B. | 若用铜盐进行化学镀铜,镀件做氧化剂 | |
| C. | 可以调节溶液的 pH 至 8-9 之间使反应停止 | |
| D. | 同等条件下,使用化学镀比电镀反应速率更快 |
| A. | 用苯和饱和溴水制溴苯 | |
| B. | 用浓盐酸和铁粉制少量氢气 | |
| C. | 用NaOH溶液除去MgC12溶液中的AlC13杂质 | |
| D. | 用右图所示装置制备乙酸乙酯 |
 ,该分子中含有官能团的名称是羟基、羧基、羰基和碳碳双键,该分子不能发生消去反应(填“能”或者“不能”).二噁英是一类物质的统称,这类物质的母体结构为
,该分子中含有官能团的名称是羟基、羧基、羰基和碳碳双键,该分子不能发生消去反应(填“能”或者“不能”).二噁英是一类物质的统称,这类物质的母体结构为 ,其中苯环上的氢原子如果被氯原子取代,所得到的物质毒性是KCN的100倍.该分子中含有官能团的名称是氯原子、醚键.
,其中苯环上的氢原子如果被氯原子取代,所得到的物质毒性是KCN的100倍.该分子中含有官能团的名称是氯原子、醚键.