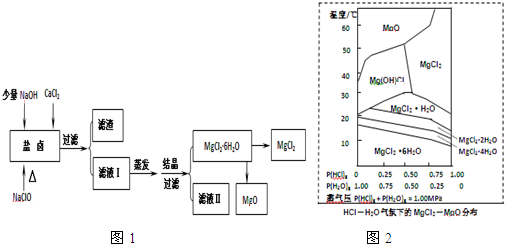
题目内容
14.下列说法正确的是( )| A. | 用含有铁粉的透气小袋与食品一起密封包装,铁粉是常用的脱氧剂 | |
| B. | 浓硫酸可以盛放在铝桶中,说明铝不能与浓硫酸反应 | |
| C. | 过滤用到的玻璃仪器有铁架台、烧杯、漏斗、玻璃棒、滤纸 | |
| D. | 用氢氟酸雕刻玻璃,说明氢氟酸是强酸 |
分析 A.铁具有还原性;
B.铝与浓硫酸发生钝化反应;
C.铁架台不是玻璃仪器;
D.氢氟酸为弱酸.
解答 解:A.铁具有还原性,常用于脱氧剂,故A正确;
B.铝与浓硫酸发生钝化反应,在表面生成一层致密的氧化膜,可起到阻碍反应的继续进行,故B错误;
C.铁架台不是玻璃仪器,故C错误;
D.氢氟酸为弱酸,可与二氧化硅反应生成四氟化硅和水,故D错误.
故选A.
点评 本题考查元素化合物知识,为高频考点,侧重于学生的双基的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大,注意相关基础知识的积累.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
4.在Na2O2与CO2的反应中,下列说法正确的是( )
| A. | 该反应中Na2O2是氧化剂,CO2是还原剂 | |
| B. | 1mol Na2O2参加反应,有2mole-转移 | |
| C. | Na2O2晶体中阴阳离子个数比为1:1 | |
| D. | Na2O2晶体中含有离子键和共价键 |
5.下列说法正确的是( )
| A. | 决定化学反应速率的主要因素是参加反应的物质的性质 | |
| B. | 催化剂可以使不起反应的物质发生反应 | |
| C. | 升温可让吸热反应加快速率,而会让放热反应减慢速率 | |
| D. | 通过增大浓度、升高温度、增大压强都可以使反应速率加快 |
6.在同温同压下,10mL气体A2和30mL气体B2完全反应可生成20mL气体C,则C的化学式为( )
| A. | A2B6 | B. | A2B3 | C. | A3B | D. | AB3 |
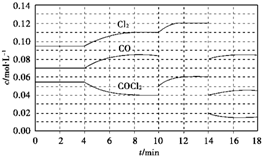
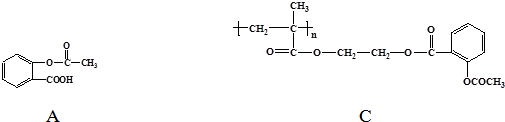
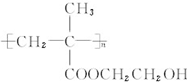 .
.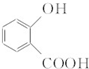 和CH3COOH(写结构简式).
和CH3COOH(写结构简式).