题目内容
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到的气体其物质的量为a mol,向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1(在相同条件下),则a可能为( )
| A、0.80 | B、0.70 |
| C、0.60 | D、0.40 |
考点:有关混合物反应的计算
专题:计算题
分析:利用极限法解答,假设混合物全是CuS,或混合物全是Cu2S,根据n=
计算n(CuO),根据Cu元素守恒计算n(CuS)、n(Cu2S),再根据电子转移数目守恒计算n(NO)、n(NO2),进而计算气体总物质的量,实际气体介于二者之间.
| m |
| M |
解答:
解:若混合物全是CuS,其物质的量n(CuS)=n(CuO)=
=0.15mol,CuS中S的化合价由-2价上升到+6价,故转移电子物质的量=0.15×(6+2)=1.2mol.NO和NO2的体积相等,设NO为xmol、NO2为xmol,根据得失电子守恒,得3x+x=1.2,解得x=0.3,则NO和NO2的总物质的量为0.3mol×2=0.6mol;
若混合物全是Cu2S,其物质的量n(Cu2S)=
n(CuO)=
×0.15mol=0.075mol,Cu2S中S的化合价由-2价上升到+6价,且Cu元素的化合价由+1价上升到+2价,故转移电子物质的量0.075×(8+1×2)=0.75mol,设NO为xmol、NO2为xmol,3x+x=0.75,根据电子得失守恒,计算得x=0.1875,故NO和NO2的总物质的量为0.1875mol×2=0.375mol,
实际气体介于0.375mol~0.6mol之间,
故选D.
| 12g |
| 80g/mol |
若混合物全是Cu2S,其物质的量n(Cu2S)=
| 1 |
| 2 |
| 1 |
| 2 |
实际气体介于0.375mol~0.6mol之间,
故选D.
点评:本题考查氧化还原反应计算、混合物计算,难度中等,注意守恒思想与极限法的利用,是对学生综合能力的考查.

练习册系列答案
相关题目
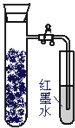 如图,向还原铁粉中加入少量的炭粉,混合均匀后,撒入内壁用NaCl溶液润湿过的具支试管中,塞紧橡皮塞.几分钟后,打开止水夹,观察到导管中水柱上升.对此过程所作的分析正确的是( )
如图,向还原铁粉中加入少量的炭粉,混合均匀后,撒入内壁用NaCl溶液润湿过的具支试管中,塞紧橡皮塞.几分钟后,打开止水夹,观察到导管中水柱上升.对此过程所作的分析正确的是( )| A、碳粉在电化学腐蚀过程中作负极 |
| B、炭粉被氧化 |
| C、发生了吸氧腐蚀 |
| D、发生了析氢腐蚀 |
下列除去杂质的方法正确的是( )
| A、除去BaSO4中少量BaCO3:加入足量盐酸,充分反应后,过滤、洗涤、干燥 |
| B、除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤 |
| C、除去CO2气体中混有的CO气体:混合气通过灼热的铜网 |
| D、除去CO2气体中混有的HCl气体:通入氢氧化钠溶液洗气 |
下列实验操作中正确的是( )
| A、蒸发操作中应使水分完全蒸干后,才能停止加热 |
| B、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
| C、分液操作时,下层液体从分液漏斗下口放出后,再将上层液体从下口放出到另一个烧杯中 |
| D、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
下列叙述正确的是( )
| A、SO2是电解质,其水溶液能导电 |
| B、酸式盐的水溶液一定呈酸性 |
| C、常温时水电离出的c(H+)=10-4mol/L的溶液,不可能是稀盐酸 |
| D、常温时纯水的电离平衡常数为1.0×10-14 |
 生活处处有化学.
生活处处有化学.