题目内容
2.现有可逆反应2NO2(g)═N2O4(g),△H<0,试根据下列图象判断t2、t3、t4时刻采取的措(只改变一种外部条件).t2:增大N2O4浓度;t3:减小压强;t4:使用催化剂.已知:A(g)+2B(g)?2C(g)△H<0.此反应的平衡常数表达式K=$\frac{{c}^{2}(C)}{c(A).{c}^{2}(B)}$,温度降低,K值会增大(增大、减小、不变),A的转化率增大,化学反应速率减小.
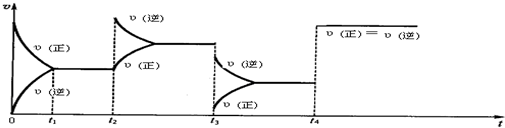
分析 t2:正反应速率不变、逆反应速率增大,平衡逆向移动,因为与原来平衡点有接触点,只能是通过增大浓度实现;
t3:正逆反应速率都减小,但逆反应速率大于正反应速率,平衡逆向移动,该反应的正反应是气体计量数减小的放热反应,据此判断改变条件;
t4:正逆反应速率都增大,且正逆反应速率都相等,且该反应前后气体计量数之和减小,据此判断改变条件;
该反应化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比;该反应的正反应是放热反应,升高温度平衡向吸热方向移动,生成物浓度减小、反应物浓度增大,单位体积内活化分子百分数减小.
解答 解:t2:正反应速率不变、逆反应速率增大,平衡逆向移动,因为与原来平衡点有接触点,只能是通过增大浓度实现,逆反应速率大于正逆反应速率,所以改变的条件是增大生成物N2O4浓度;
t3:正逆反应速率都减小,但逆反应速率大于正反应速率,平衡逆向移动,该反应的正反应是气体计量数减小的放热反应,改变的条件是减小压强;
t4:正逆反应速率都增大,且正逆反应速率都相等,且该反应前后气体计量数之和减小,所以改变的条件是使用催化剂;
该反应化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比,K=$\frac{{c}^{2}(C)}{c(A).{c}^{2}(B)}$;该反应的正反应是放热反应,升高温度平衡向吸热方向移动,生成物浓度减小、反应物浓度增大,所以化学平衡常数增大;温度降低,单位体积内活化分子百分数减小,反应速率减小,平衡正向移动,所以A的转化率增大,
故答案为:t2:增大四氧化二氮浓度;压强减小;使用了催化剂;
K=$\frac{{c}^{2}(C)}{c(A).{c}^{2}(B)}$;增大;增大;减小.
点评 本题考查图象分析,为高频考点,明确外界条件对化学反应速率、化学平衡影响原理是解本题关键,会v-t图象与改变条件的关系,题目难度不大.

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案| A. | MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| B. | Na2O2 溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O | |
| D. | 新制的氧化铝可溶于氢氧化钠溶液:Al2O3+2OH-═2AlO2-+H2O |
 ),下列说法中错误的是( )
),下列说法中错误的是( )| A. | 若Y是C4H8,则X可能是N2 | B. | 分子数目:X=Z=2Y | ||
| C. | 若X是O2,则Z不可能是CO2 | D. | 气体密度:X=Z=2Y |
| A. | 6:3:2 | B. | 3:2:1 | C. | 1:2:3 | D. | 1:1:1 |
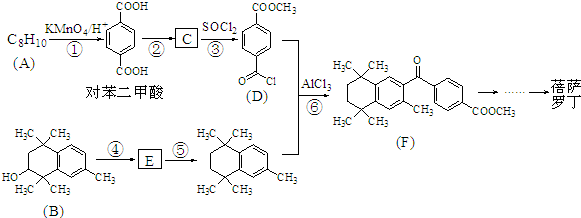
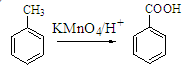 Ⅱ.
Ⅱ.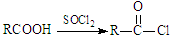
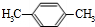 ,C的结构简式为
,C的结构简式为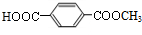 .
. ;⑤
;⑤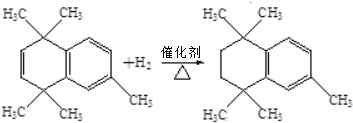 .
.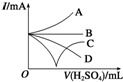 向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题: