题目内容
20.现有下列十种物质:①液态氯化氢 ②小苏打 ③固体纯碱 ④二氧化碳 ⑤葡萄糖 ⑥氢氧化钾 ⑦氢氧化铁胶体 ⑧氨水 ⑨Al ⑩硫酸铁溶液(1)上述十种物质中,属于电解质的有①②③⑥,属于非电解质的有④⑤.
(2)有两种物质在水溶液中可发生反应,离子方程式为:H++OH-=H2O,该反应的化学方程式为HCl+KOH=H2O+KCl.
(3)除去③中少量②的操作是加热,⑨在空气中能稳定存在的原因铝化学性质非常活沷,容易与空气中的氧气发生反应形成一层致密的氧化膜,阻止里面的铝继续与氧气反应.
(4)标准状况下,4.48L ④中含有0.4mol 氧原子.
(5)现有100mL⑩溶液中含Fe3+5.6g,则溶液中SO42-的物质的量浓度是1.5mol/L.
(6)若在⑦中缓慢加入⑥的水溶液,产生的现象是产生红褐色沉淀.
(7)将①加入到⑥的溶液中,⑥的溶液导电能力变化为基本不变(填“增强”、“减弱”或“基本不变”)
分析 (1)电解质:在水溶液中或熔融状态下能够导电的化合物;
非电解质:在熔融状态和水溶液中都不能导电的化合物;
(2)离子方程式为:H++OH-═H2O,可表示强酸与强碱反应生成可溶性盐和水的离子反应;
(3)根据碳酸钠加热不分解,碳酸氢钠加热分解得到碳酸钠、水、二氧化碳来解答,铝是活泼金属在空气中表面形成氧化铝保护膜;
(4)根据n=$\frac{V}{{V}_{m}}$结合分子的构成计算.
(5)根据n=$\frac{m}{M}$计算Fe3+的物质的量,溶液中2n(SO42-)=3n(Fe3+),再根据c=$\frac{n}{V}$计算SO42-的物质的量浓度;
(6)胶体加入电解质会发生聚沉;
(7)电解质溶液导电能力强弱取决于离子浓度的大小,氨水中加入盐酸依据反应物和生成物的性质判断离子浓度的变化进而判断导电能力变化;
解答 解:(1)①液态氯化氢在水溶液中能导电,是电解质;
②NaHCO3在水溶液或者熔融状态下能够导电,是电解质;
③固体纯碱在水溶液或者熔融状态下能够导电,是电解质;
④二氧化碳水溶液中反应生成电解质溶液导电,本身不能电离属于非电解质;
⑤葡萄糖在水溶液和熔融状态下都不能够导电,是非电解质;
⑥氢氧化钾在水溶液或者熔融状态下能够导电,是电解质;
⑦氢氧化铁胶体属于混合物 既不是电解质也不是非电解质;
⑧氨水属于混合物 既不是电解质也不是非电解质;
⑨Al 属于单质能导电,既不是电解质也不是非电解质;
⑩硫酸铁溶液属于混合物 既不是电解质也不是非电解质;
故属于电解质的是:①②③⑥,非电解质的有:④⑤;
故答案为:①②③⑥;④⑤;
(2)离子方程式为:H++OH-═H2O,可表示强酸与强碱反应生成可溶性盐和水的离子反应,如HCl+KOH=H2O+KCl;
故答案为:HCl+KOH=H2O+KCl;
(3)根据碳酸钠加热不分解,碳酸氢钠加热分解得到碳酸钠、水、二氧化碳,所以除去固体纯碱中少量小苏打的操作是加热,方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,⑨在空气中能稳定存在的原因是铝化学性质非常活沷,容易与空气中的氧气发生反应形成一层致密的氧化膜,阻止里面的铝继续与氧气反应,
故答案为:加热;铝化学性质非常活沷,容易与空气中的氧气发生反应形成一层致密的氧化膜,阻止里面的铝继续与氧气反应;
(4)n(CO2)=$\frac{1}{2}$n(O)=0.2mol,V(CO2)=0.2mol×22.4L/mol=4.48L;
故答案为:4.48;
(5)Fe3+的物质的量为$\frac{5.6g}{56g/mol}$=0.1mol,溶液中2n(SO42-)=3n(Fe3+),则SO42-的物质的量为0.1mol×$\frac{3}{2}$=0.15mol,SO42-的物质的量浓度为$\frac{0.15mol}{0.1L}$=1.5mol/L;
故答案为:1.5mol/L;
(6)若在氢氧化铁胶体中缓慢加入氢氧化钾,胶体发生聚沉,产生的现象是产生红褐色沉淀;
故答案为:产生红褐色沉淀;
(7)将①液态氯化氢加入到⑥氢氧化钾 的溶液中,⑥的溶液导电能力变化基本不变,
故答案为:基本不变;
点评 本题考查了物质导电的条件,电解质和非电解质的概念,胶体的性质,离子方程式书写,物质的量有关计算等,题目综合性强,氢氧化铁胶体性质的考查是本题的难点,题目难度中等.

①锌粒 ②芯片 ③锌粉 ④10%的稀硫酸 ⑤15%的稀硫酸 ⑥20%的稀硫酸
⑦加热 ⑧用水冷却 ⑨不断搅拌 ⑩迅速加入锌片后静置.
| A. | ③⑥⑦⑩ | B. | ①④⑧⑩ | C. | ③⑥⑦⑨ | D. | ③⑤⑦⑨ |

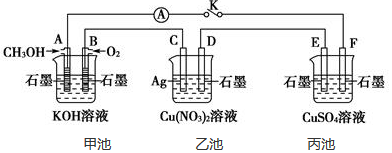
| A. | 甲中负极反应式为Ag++e-═Ag | |
| B. | 丙中H+向碳棒方向移动 | |
| C. | 乙中阳极反应式为2H++2e-═H2↑ | |
| D. | 丁中电解开始时阳极产生黄绿色气体 |
| A. | 氢氟酸 | B. | 硫酸 | C. | 碳酸钠溶液 | D. | 氧氧化钠溶液 |


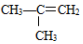 ②
②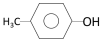 ;③
;③ ;④CH3CH2Cl;⑤CCl4;⑥CH3C≡CH;⑦HOCH2CH2OH;⑧CH3CH2OH;根据官能团的不同可分为( )
;④CH3CH2Cl;⑤CCl4;⑥CH3C≡CH;⑦HOCH2CH2OH;⑧CH3CH2OH;根据官能团的不同可分为( ) 反应①②均为工业上的重要反应。
反应①②均为工业上的重要反应。