题目内容
16.现有三种短周期元素①H ②Na ③Cl.(1)②的单质在③的单质中燃烧,产生白烟,生成物是一种离子化合物(填“离子”或“共价”),反应的化学方程式是2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl.
(2)①与③形成的化合物的电子式是
 ,该化合物中含有极性共价键(填“极性”或“非极性”).
,该化合物中含有极性共价键(填“极性”或“非极性”).
分析 (1)②的单质在③的单质中燃烧,产生白烟,生成物是氯化钠,为离子化合物;
(2)①与③形成的化合物为HCl,含有极性共价键,为共价化合物.
解答 解:(1)②的单质在③的单质中燃烧,产生白烟,生成物是氯化钠,为离子化合物,反应方程式为2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl,
故答案为:离子;2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl;
(2)①与③形成的化合物为HCl,电子式为 ,含有极性共价键,为共价化合物,故答案为:
,含有极性共价键,为共价化合物,故答案为: ;极性.
;极性.
点评 本题考查离子键、共价键的类型和识别,为高频考点,侧重于学生的分析能力的考查,注意把握物质的性质、电子式的书写以及化学键类型的判断,难度不大.

练习册系列答案
 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
7.下列物质属于弱电解质的是( )
| A. | H2SO4 | B. | NaCl | C. | NaOH | D. | CH3COOH |
11.实验室用锌与盐酸反应制取氢气.下列措施中,能加快反应速率的是( )
| A. | 降低温度 | B. | 用铁代替锌 | C. | 增大盐酸浓度 | D. | 用锌粒代替锌粉 |
1.某同学完成如下探究实验:
实验目的:比较Cl2、Br2、I2三种单质的氧化性强弱
实验药品:NaBr溶液、KI溶液、氯水、淀粉溶液
实验记录:
反思与评价:
(1)步骤①反应的离子方程式为:2Br-+Cl2=Br2+2Cl-.
(2)检验②中所得黄色溶液含I2的另一种方法是(简述实验操作和相应的实验现象)
向溶液中加入CCl4,振荡,静置,液体分为上下两层,下层呈紫红色.
(3)你认为上述实验设计(填“能”或“不能”)不能达到实验目的,理由是①中所得黄色溶液中可能含有Cl2,会干扰Br2、I2氧化性的比较.
实验目的:比较Cl2、Br2、I2三种单质的氧化性强弱
实验药品:NaBr溶液、KI溶液、氯水、淀粉溶液
实验记录:
| 实验步骤 | 实验现象 | 实验结论 |
 | 溶液变为黄色 | 氧化性:Cl2>Br2 |
 | 溶液变为黄色 | 氧化性: Br2>I2 |
 | 溶液的颜色由黄色变为蓝色 |
(1)步骤①反应的离子方程式为:2Br-+Cl2=Br2+2Cl-.
(2)检验②中所得黄色溶液含I2的另一种方法是(简述实验操作和相应的实验现象)
向溶液中加入CCl4,振荡,静置,液体分为上下两层,下层呈紫红色.
(3)你认为上述实验设计(填“能”或“不能”)不能达到实验目的,理由是①中所得黄色溶液中可能含有Cl2,会干扰Br2、I2氧化性的比较.
8.向一密闭容器中充入1mol N2和3mol H2,在一定条件下反应发生,下列有关说法正确的是( )
| A. | 达到化学平衡时,N2将完全转化为NH3 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度之比为l:3:2 | |
| C. | 达到化学平衡时'容器内气体的平均摩尔质量不再变化 | |
| D. | 达到化学平衡时,正反应和逆反应的速率都为零 |
6.某溶液中含有HCO3-,CO32-,SO32-,Na+,NO3-五种离子,若向其中加入足量的试剂Q,充分反应后溶被中有n种离子(不考虑水电离出的离子)的物质的量保持不变,下列有关Q、n的分析中错误的是( )
| 选项 | A | B | C | D |
| Q | Na2O2 | SO2 | BaCl2 | AlCl3 |
| n | 1 | 1 | 4 | 2 |
| A. | A | B. | B | C. | C | D. | D |
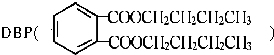 是一种常见的塑化剂,
是一种常见的塑化剂,
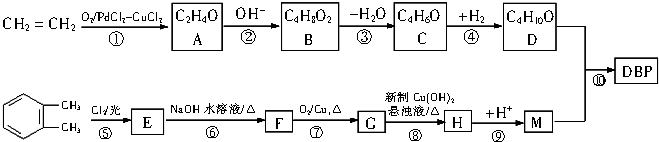
 .
. .
.
 .
.