题目内容
19.某无色溶液X,由K+、NH4+、Ba2+、Al3+、Fe3+、CO32-、SO42-中的若干种离子组成,取该溶液进行如下实验: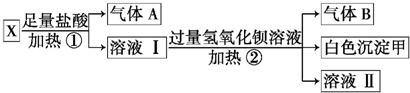
(1)白色沉淀甲是BaSO4.
(2)试写出实验过程中生成气体B的离子方程式NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(3)通过上述实验,可确定X溶液中一定存在的离子是NH4+、CO32-、SO42-.
分析 无色溶液中不存在有色的Fe3+,加过量盐酸生成气体和溶液,则溶液中一定含CO32-,一定不含有与CO32-反应的Ba2+、Al3+,气体A为CO2;溶液I加入过量氢氧化钡反应生成气体B为氨气,白色沉淀甲是硫酸钡,说明一定含有NH4+、SO42-,以此来解答.
解答 解:无色溶液中不存在有色的Fe3+,加过量盐酸生成气体和溶液,则溶液中一定含CO32-,一定不含有与CO32-反应的Ba2+、Al3+,气体A为CO2;溶液I加入过量氢氧化钡反应生成气体B为氨气,白色沉淀甲是硫酸钡,说明一定含有NH4+、SO42-,
(1)白色沉淀甲是BaSO4,故答案为:BaSO4;
(2)实验过程中生成气体B的离子方程式为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
(3)由上述分析可知,X溶液中一定存在的离子是NH4+、CO32-、SO42-,故答案为:NH4+、CO32-、SO42-.
点评 本题考查无机物的推断,为高频考点,把握离子的性质、离子之间的反应为解答的关键,侧重分析与推断能力的考查,注意沉淀及气体的判断,题目难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
9.在PH=1的溶液中,下列各组离子一定能存在的是( )
| A. | Na+、NO3-、Al3+、K+ | B. | Na+、ClO3-、ClO-、ClO4- | ||
| C. | K+、Cr2O72-、I-、Na+ | D. | Na+、SO32-、SO42-、NH4+ |
7.下列四个试管中,发生如下反应:CaCO3+2HCl═CaCl2+H2O+CO2↑,产生气体的速率最快的是( )
| 试管 | CaCO3的状态 | 盐酸的浓度 | 温度 |
| A | 块状 | 1mol•L-1 | 20℃ |
| B | 粉末状 | 1mol•L-1 | 20℃ |
| C | 块状 | 2mol•L-1 | 40℃ |
| D | 粉末状 | 2mol•L-1 | 40℃ |
| A. | A | B. | B | C. | C | D. | D |
14.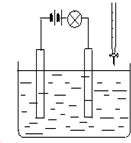 在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
 在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )| A. | 盐酸中逐滴加入食盐溶液 | B. | 硫酸中逐滴加入氢氧化钠溶液 | ||
| C. | 硫酸中逐滴加入氢氧化钡溶液 | D. | 醋酸中逐渐加入氢氧化钠溶液 |
4.下列物质不能使蛋白质变性的是( )
| A. | 紫外线 | B. | 福尔马林 | C. | 硫酸钠 | D. | 浓盐酸 |
8.下列叙述中正确的是( )
| A. | Cu和足量的稀硝酸反应产生4.48 L气体时,转移的电子数为0.6×6.02×1023 | |
| B. | 常温常压下,8.8 g CO2和N2O混合物中所含有的原子总数为0.6×6.02×1023 | |
| C. | 标准状况下,3.36 L己烷中含有的分子数目为0.15×6.02×1023 | |
| D. | 在1 L 0.2 mol/L的硫酸铁溶液中含有的三价铁离子数为0.4×6.02×1023 |
7.下列四种烃的命名不正确的是( )
| A. | 2-甲基-3-己炔 | B. | 2-甲基丙烷 | C. | 3-甲基-2-丁烯 | D. | 2-甲基-2-丁烯 |
 (2)H2H:H(3)MgCl2
(2)H2H:H(3)MgCl2
 (5)CO2
(5)CO2 (6)Na2O
(6)Na2O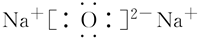
 ;O=C=O.
;O=C=O.