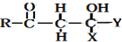题目内容
15.已知A+、B2+、C-、D2-具有相同的电子层结构,有关A、B、C、D四种元素的叙述中正确的是( )| A. | 原子序数:B>A>D>C | B. | 原子半径:A>B>C>D | ||
| C. | 金属性:A>B,非金属性:C>D | D. | 离子半径:D2->C->B2+>A+ |
分析 A+、B2+、C-、D2-四种离子均具有相同的电子层结构,则有原子序数:B>A>C>D,且A与B同周期,C与D同周期,A、B在周期表中C、D的下一周期,由电荷可知,A、B为金属元素,C、D为非金属性元素.
同周期自左而右原子半径减小、同主族自上而下原子半径增大,同周期自左而右金属性减弱、非金属性增强,电子层结构相同的离子,核电荷数越大离子半径越小,据此分析.
解答 解:A+、B2+、C-、D2-四种离子均具有相同的电子层结构,则有原子序数:B>A>C>D,且A与B同周期,C与D同周期,A、B在周期表中C、D的下一周期.
A.A+、B2+、C-、D2-四种离子均具有相同的电子层结构,则有原子序数:B>A>C>D,故A错误;
B.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:A>B>D>C,故B错误;
C.由电荷可知,A、B为金属元素,C、D为非金属性元素,同周期自左而右金属性减弱、非金属性增强,故金属性:A>B,非金属性:C>D,故C正确;
D.核电荷数:D<C<A<B,电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:D2->C->A+>B2+,故D错误.
故选C.
点评 本题考查位置结构性质的相互关系及应用,明确核外电子排布确定元素所在周期表中的位置以及把握元素周期律的递变规律是解答该题的关键,题目难度不大.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
5.下列叙述正确的是( )
| A. | 金属元素和非金属元素形成的化合物一定是离子化合物 | |
| B. | 18O2和18O3互为同素异形体,相同状况下其密度之比为2:3 | |
| C. | 过渡元素都是副族元素 | |
| D. | 同主族元素的原子最外层电子数相同,化学性质也相同 |
6.水溶液中能大量共存的一组离子是( )
| A. | Na+、Ba2+、Cl-、SO42- | B. | Fe2+、H+、S2-、ClO- | ||
| C. | Mg2+、NH4+、Cl-、SO42- | D. | K+、OH-、NO3-、HSO3- |
3.关于丙醇(CH3CH2CH2OH)分子的说法正确的是( )
| A. | 分子中共含有11个极性键 | B. | 分子中含有配位键 | ||
| C. | 分子中只含σ键 | D. | 分子中含有1个π键 |
10.下列各组物质中,互称为同分异构体的是( )
| A. | 水与冰 | B. | O2与O3 | C. | 石墨与金刚石 | D. |  与 与  |
20.短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如表:
(1)D原子结构示意图为: ,E在周期表中的位置为:第三周期第ⅦA族.
,E在周期表中的位置为:第三周期第ⅦA族.
(2)B和C形成的化合物的电子式为: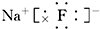 .
.
(3)B和D简单离子的半径大小为:F->Al3+.
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是:ae(填序号).
a.比较两种单质的颜色 b.比较两种单质与H2化合的难易程度
c.依据两元素在周期表中的位置 d.比较对应阴离子的还原性
e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比1:4,相对分子质量为154,则该物质的化学式为:CCl4.
| 元素编号 | 元 素 特 征 信 息 |
| A | 最外层电子数是次外层电子数的2倍 |
| B | 和E同主族 |
| C | 1mol C单质能与冷水反应,在标准状况下生成11.2L H2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负一价阴离子的电子层结构与Ar原子相同 |
 ,E在周期表中的位置为:第三周期第ⅦA族.
,E在周期表中的位置为:第三周期第ⅦA族.(2)B和C形成的化合物的电子式为:
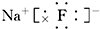 .
.(3)B和D简单离子的半径大小为:F->Al3+.
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是:ae(填序号).
a.比较两种单质的颜色 b.比较两种单质与H2化合的难易程度
c.依据两元素在周期表中的位置 d.比较对应阴离子的还原性
e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比1:4,相对分子质量为154,则该物质的化学式为:CCl4.
4.短周期主族元素A、B、C、D,原子序数依次增大.A、C的原子序数的差为8,A、B、C三种元素原子的最外层电子数之和为10,B原子最外层电子数等于A原子最外层电子数的一半.下列叙述正确的是( )
| A. | 原子半径:A<B<C<D | |
| B. | 非金属性:A<C | |
| C. | 最高价氧化物对应水化物的酸性:D>C | |
| D. | B的最高价氧化物对应的水化物为强碱 |
2. X、Y、Z、R、T为周期表前四周期的元素,原子序数依次增大.X元素的一种核素无中子存在,Y的2p能级中有1个空轨道,Z的单质为空气的主要成分,R的最外层电子数为其内层电子数的3倍,T原子的价层电排布式是3d74s2.回答下列问题:
X、Y、Z、R、T为周期表前四周期的元素,原子序数依次增大.X元素的一种核素无中子存在,Y的2p能级中有1个空轨道,Z的单质为空气的主要成分,R的最外层电子数为其内层电子数的3倍,T原子的价层电排布式是3d74s2.回答下列问题:
(1)T原子的价层电子排布图是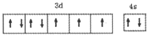 .
.
(2)在Y2X4分子中,Y原子的杂化轨道类型是sp2.
(3)用“<”或“>”填空:
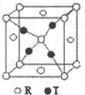
(4)R和T形成的一种离子晶体结构如图,则该晶体中T离子的配位数是4.
(5)TR放入足量的XYZ溶液(呈弱酸性,分解温度1200℃)中,微热产生一种气体单质和[T(YZ)6]3-离子,该反应的离子方程式为2CoO+12HCN=2[Co(CN)6]3-+6H++H2↑+2H2O.
 X、Y、Z、R、T为周期表前四周期的元素,原子序数依次增大.X元素的一种核素无中子存在,Y的2p能级中有1个空轨道,Z的单质为空气的主要成分,R的最外层电子数为其内层电子数的3倍,T原子的价层电排布式是3d74s2.回答下列问题:
X、Y、Z、R、T为周期表前四周期的元素,原子序数依次增大.X元素的一种核素无中子存在,Y的2p能级中有1个空轨道,Z的单质为空气的主要成分,R的最外层电子数为其内层电子数的3倍,T原子的价层电排布式是3d74s2.回答下列问题:(1)T原子的价层电子排布图是
 .
.(2)在Y2X4分子中,Y原子的杂化轨道类型是sp2.
(3)用“<”或“>”填空:
| 电负性 | 原子半径 | 沸点 | 酸性 |
| Y<Z | Z>R | Y2X6<YX4R | XZR3>XZR2 |
(5)TR放入足量的XYZ溶液(呈弱酸性,分解温度1200℃)中,微热产生一种气体单质和[T(YZ)6]3-离子,该反应的离子方程式为2CoO+12HCN=2[Co(CN)6]3-+6H++H2↑+2H2O.
 +
+ $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$