��Ŀ����
 ��ͼ����ѧ��ѧijЩ����֮����һ�������µ��ת����ϵ����֪A��һ�ֳ�����Һ̬�����C��D��G��H��K�ǵ��ʣ�����Ϊ�����G��K����ͨ���е�������ҪԪ�أ�����K�����٣�E��F��Ӧ��Һ��������෴��F����ɫ��ӦΪ��ɫ���밴Ҫ������
��ͼ����ѧ��ѧijЩ����֮����һ�������µ��ת����ϵ����֪A��һ�ֳ�����Һ̬�����C��D��G��H��K�ǵ��ʣ�����Ϊ�����G��K����ͨ���е�������ҪԪ�أ�����K�����٣�E��F��Ӧ��Һ��������෴��F����ɫ��ӦΪ��ɫ���밴Ҫ��������1��д��������ĵ���ʽ��
��2����д��A��J��Ӧ�����ӷ���ʽ��
��3��B������ϡ���ᷴӦ�����μӷ�Ӧ������Ϊ4mol��ת�Ƶ��ӵ����ʵ���Ϊ
��4����֪��200�棬101Kpa�£�0.12g����K��A��ȫ��Ӧ����C��I��������1316J��������д���˷�Ӧ���Ȼ�ѧ����ʽ��
��5������PtΪ�缫����I��D�Լ�F����Һ���ԭ��أ��������ĵ缫��ӦΪ��
�����ô˵�ص��300mL5mol/L���Ȼ�����Һһ��ʱ�䣬�������ռ�����״����3.36L���壬��ʱ��Һ��pHΪ
�������õ���������Һ��ͨ�������̼����4.48L����״��������ʱ��Һ����������Ũ�ȵĹ�ϵ�ɴ�С��˳��Ϊ��
���㣺������ƶ�
ר�⣺�ƶ���
������A��һ�ֳ�����Һ̬�����JΪ����ɫ���壬�������Ӧ����F�뵥��D��F����ɫ��ӦΪ��ɫ��˵������NaԪ�أ��÷�Ӧ�ǹ���������ˮ�ķ�Ӧ������֪AΪH2O��JΪNa2O2��FΪNaOH��DΪO2��ˮ��H��Ӧ����������E��E��F��Ӧ��Һ��������෴������֪HΪF2��EΪHF��G��K��̼�ظ��е�������ҪԪ�أ�����K�����٣���GΪFe��KΪC��̼��ˮ��Ӧ���ɵ���C�뻯����I����CΪH2��IΪCO��Fe��ˮ��Ӧ���ɻ�����B����������BΪFe3O4���ݴ˽��
���
�⣺A��һ�ֳ�����Һ̬�����JΪ����ɫ���壬�������Ӧ����F�뵥��D��F����ɫ��ӦΪ��ɫ��˵������NaԪ�أ��÷�Ӧ�ǹ���������ˮ�ķ�Ӧ������֪AΪH2O��JΪNa2O2��FΪNaOH��DΪO2��ˮ��H��Ӧ����������E��E��F��Ӧ��Һ��������෴������֪HΪF2��EΪHF��G��K��̼�ظ��е�������ҪԪ�أ�����K�����٣���GΪFe��KΪC��̼��ˮ��Ӧ���ɵ���C�뻯����I����CΪH2��IΪCO��Fe��ˮ��Ӧ���ɻ�����B����������BΪFe3O4��
��1��������EΪHF��Fԭ����Hԭ��֮���γ�1�Թ��õ��Ӷԣ������ʽΪ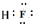 ��
��
�ʴ�Ϊ��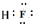 ��
��
��2���ٹ���������ˮ��Ӧ�����ӷ���ʽΪ��2H2O+2Na2O2=4Na++4OH-+O2����
�ڽ������ķ���ͨ��NaOH����Һ�У���Ӧ�������ӷ���ʽΪ��2F2+4OH-=4F-+O2+2H2O��
�ʴ�Ϊ��2H2O+2Na2O2=4Na++4OH-+O2����2F2+4OH-=4F-+O2+2H2O��
��3��BΪFe3O4��������ϡ���ᷴӦʱ������Fe��NO3��3��NO��������Fe��NO3��3Ϊxmol�����μӷ�Ӧ������Ϊ4mol��������NOΪ��4-3x��mol�����ݵ���ת���غ��֪��xmol����3-
��=��4-3x��mol����5-2�������x=
���ʷ�Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ��4-
��3 ��mol����5-2��=0.43mol��
�ʴ�Ϊ��0.43��
��4��200�棬101Kpa�£�0.12g����̼��ˮ��ȫ��Ӧ����CO��������������1316J����������1mol̼��Ӧ���յ�����=1.316kJ��
=131.6kJ����÷�Ӧ�Ȼ�ѧ����ʽΪ��C��s��+H2O��g��=CO��g��+H2��g����H=+131.6kJ/mol ��200�棬101Kpa����
�ʴ�Ϊ��C��s��+H2O��g��=CO��g��+H2��g����H=+131.6kJ/mol ��200�棬101Kpa����
��5������PtΪ�缫����CO�������Լ�NaOH����Һ���ԭ��أ�CO����������Ӧ������������ԭ��Ӧ��������������õ��ӣ����������������������������ķ�ӦʽΪ��O2+4e-+2H2O=4OH-��
�ʴ�Ϊ��O2+4e-+2H2O=4OH-��
�����ô˵�ص��300mL 5mol/L���Ȼ�����Һһ��ʱ�䣬�������ռ���״��������3.36L����
2NaCl+2H2O
2NaOH+H2��+Cl2��
2mol 22.4L
n��NaOH�� 3.36L
���ԣ�2mol��n��NaOH��=22.4L��3.36L�����n��NaOH��=0.3mol����c��NaOH��=
=1mol/L��
����Һ��c��H+��=10-14mol/L������ҺpH=-lg10-14=14��
�ʴ�Ϊ��14��
����Һ��ʣ��NaClΪ0.3L��5mol/L-0.3mol=1.2mol�������õ���������Һ��ͨ�������̼����4.48L����״�����������ʵ���=
=0.2mol��n��NaOH������CO2��=3��2������1��1��n��NaOH������CO2������2��1��������̼���ơ�̼�����ƣ�����ߵ����ʵ����ֱ�Ϊ��amol��bmol����NaԪ�ء�CԪ���غ�ɵã�a+b=0.2��2a+b=0.3�����a=0.1��b=0.1��̼�����̼�����ˮ�⣬��Һ�ʼ��ԣ�̼�����ˮ��̶ȴ���̼���������c��Cl-����c��HCO3-����c��CO32-������Һ��������Ũ�Ȳ��䣬��Ũ�������������Һ�и�����Ũ�ȴ�С��ϵΪ��c��Na+����c��Cl-����c��HCO3-����c��CO32-����c��OH-����c��H+��
�ʴ�Ϊ��c��Na+����c��Cl-����c��HCO3-����c��CO32-����c��OH-����c��H+����
��1��������EΪHF��Fԭ����Hԭ��֮���γ�1�Թ��õ��Ӷԣ������ʽΪ
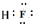 ��
���ʴ�Ϊ��
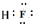 ��
����2���ٹ���������ˮ��Ӧ�����ӷ���ʽΪ��2H2O+2Na2O2=4Na++4OH-+O2����
�ڽ������ķ���ͨ��NaOH����Һ�У���Ӧ�������ӷ���ʽΪ��2F2+4OH-=4F-+O2+2H2O��
�ʴ�Ϊ��2H2O+2Na2O2=4Na++4OH-+O2����2F2+4OH-=4F-+O2+2H2O��
��3��BΪFe3O4��������ϡ���ᷴӦʱ������Fe��NO3��3��NO��������Fe��NO3��3Ϊxmol�����μӷ�Ӧ������Ϊ4mol��������NOΪ��4-3x��mol�����ݵ���ת���غ��֪��xmol����3-
| 8 |
| 3 |
| 9 |
| 7 |
| 9 |
| 7 |
�ʴ�Ϊ��0.43��
��4��200�棬101Kpa�£�0.12g����̼��ˮ��ȫ��Ӧ����CO��������������1316J����������1mol̼��Ӧ���յ�����=1.316kJ��
| 1mol��12g/mol |
| 0.12g |
�ʴ�Ϊ��C��s��+H2O��g��=CO��g��+H2��g����H=+131.6kJ/mol ��200�棬101Kpa����
��5������PtΪ�缫����CO�������Լ�NaOH����Һ���ԭ��أ�CO����������Ӧ������������ԭ��Ӧ��������������õ��ӣ����������������������������ķ�ӦʽΪ��O2+4e-+2H2O=4OH-��
�ʴ�Ϊ��O2+4e-+2H2O=4OH-��
�����ô˵�ص��300mL 5mol/L���Ȼ�����Һһ��ʱ�䣬�������ռ���״��������3.36L����
2NaCl+2H2O
| ||
2mol 22.4L
n��NaOH�� 3.36L
���ԣ�2mol��n��NaOH��=22.4L��3.36L�����n��NaOH��=0.3mol����c��NaOH��=
| 0.3mol |
| 0.3L |
����Һ��c��H+��=10-14mol/L������ҺpH=-lg10-14=14��
�ʴ�Ϊ��14��
����Һ��ʣ��NaClΪ0.3L��5mol/L-0.3mol=1.2mol�������õ���������Һ��ͨ�������̼����4.48L����״�����������ʵ���=
| 44.8L |
| 22.4L/mol |
�ʴ�Ϊ��c��Na+����c��Cl-����c��HCO3-����c��CO32-����c��OH-����c��H+����
���������⿼�������ƶϣ��漰Na��F��C��FeԪ�ص��ʻ����������Լ����û�ѧ���������ԭ��Ӧ���㡢ԭ��ء����ԭ�����������㡢����Ũ�ȱȽϵȣ���3��������Fe��ƽ�����ϼۣ����㣬��5��������Ũ�ȱȽ�Ϊ�״��㣬ѧ��������ʣ���NaCl��

��ϰ��ϵ�д�
�����Ŀ
�����йص������Һ���������ʵ���Ũ�ȹ�ϵ��ȷ���ǣ�������
| A��0.1mol/L NaHCO3��Һ�У�c��H+��+c��Na+��=c��OH-��+c��HCO3-��+c��CO32-�� |
| B��һ����NH4Cl��NH3?H2O������õ�������Һ�У�c��NH4+����c��Cl-�� |
| C��0.2mol/L CH3COOH��Һ�У�c��CH3COOH��+c��CH3COO-��=0.4mol/L |
| D�����ʵ���Ũ����ȵĢ�NH4HSO4��Һ����NH4HCO3��Һ����NH4Cl��Һ�У�c��NH4+���Ĵ�С��ϵ���٣��ڣ��� |
���ڿ��淴ӦA��g��+2B��g��?C��g����һ�������´ﵽƽ��״̬�ı�־�ǣ�������
| A���ں��ݵ��ܱ������л��������ܶȲ��� |
| B���ں��ݵ��ܱ������л�������ѹǿ���� |
| C��A��B��C��Ũ��֮��Ϊ1��2��1���ұ��ֲ��� |
| D��A������������C������������� |
���л�ѧ����ʽ��д��ȷ���ǣ�������
| A���Ȼ�����Һ��ͨ������������̼��CaCl2+CO2+H2O=CaCO3��+2HCl | ||||
B������������ȼ�գ�Fe+Cl2
| ||||
| C����ú����ȡ���Ľ�������С���и���и���䰵��4Na+O2=2Na2O | ||||
| D����������ˮ���Ȼ�����Һ��Ӧ��Br2+2KCl=2KBr+Cl2 |
����������Ԫ��A��B��C��D��ԭ��������������A��B�γɵ���̬�������ˮ��Һ�ʼ��ԣ�Bλ�ڵ�VA�壬A��Cͬ���壬Dԭ����������������Ӳ�����ȣ�����������ȷ���ǣ�������
| A��Ԫ��B��C��D������������Ӧ��ˮ���������Ӧ |
| B��ԭ�Ӱ뾶��D��C��B |
| C��Ԫ��A��B��C���������Ϊ���ۻ����� |
| D�����ʵĻ�ԭ�ԣ�D��C |

 ��ӦA��g��+B��g��?C��g��+D��g�������е������仯��ͼ��ʾ���ش��������⣺
��ӦA��g��+B��g��?C��g��+D��g�������е������仯��ͼ��ʾ���ش��������⣺ A��B��C��D��E����Ԫ�����ڱ��е�ǰ20��Ԫ�أ�ԭ��������������B��C��Dͬ���ڣ�A��Dԭ����ijp�ܼ�������5�����ӣ�E������Ԫ�ؼȲ���ͬ����Ҳ����ͬ���壬B��C��D������������ˮ����������Ͼ��ܷ�����Ӧ�����κ�ˮ��
A��B��C��D��E����Ԫ�����ڱ��е�ǰ20��Ԫ�أ�ԭ��������������B��C��Dͬ���ڣ�A��Dԭ����ijp�ܼ�������5�����ӣ�E������Ԫ�ؼȲ���ͬ����Ҳ����ͬ���壬B��C��D������������ˮ����������Ͼ��ܷ�����Ӧ�����κ�ˮ��