题目内容
2.有一锌粉样品,因有部分锌被氧化而含氧为0.5%,氧化锌的化学式为ZnO,则样品游离锌的质量分数为97.47%.分析 锌粉样品中含ZnO和游离锌,在ZnO中,Zn和O原子的质量之比为65:16,根据样品中氧元素的质量分数可得ZnO中锌元素的质量分数,从而求得游离锌的质量分数.
解答 解:锌粉样品中含ZnO和游离锌,由于样品中氧元素的质量分数为0.5%,而在ZnO中,Zn和O原子的质量之比为65:16,故ZnO中的锌元素的质量分数=0.5%×$\frac{65}{16}$=2.03%,故样品中的游离锌的质量分数=100%-0.5%-2.03%=97.47%,故答案为:97.47%.
点评 本题考查了混合物中的元素的质量分数的求算,应注意的是在ZnO中,锌元素和氧元素的质量之比为定值,从而得出解题思路.

练习册系列答案
相关题目
12.如图是研究二氧化硫性质的微型实验装置.现用60%硫酸液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )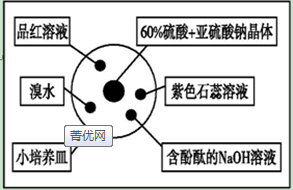

| A. | 品红溶液褪色 | B. | 溴水橙色褪去 | ||
| C. | 含酚酞的NaOH溶液红色变浅 | D. | 紫色石蕊溶液先变红后褪色 |
13.将少量铁粉加到过量的氯化铁溶液中,充分反应后,正确的结论是( )
| A. | 部分铁粉被氧化 | B. | 全部Fe3+被还原 | C. | 溶液质量减轻 | D. | 溶液质量增加 |
10.甲烷分子是以C原子为中心的正四面体结构,而不是正方形的平面结构,理由是( )
| A. | CH3Cl只代表一种物质 | B. | CH2Cl2只代表一种物质 | ||
| C. | CHCl3只代表一种物质 | D. | CCl4和CH4的结构相同 |
17.NA代表阿伏伽德罗常数,下列叙述正确的是( )
| A. | 1mol铵根离子与[H3O]+构型相同 | |
| B. | 25℃时,pH=13的NaOH溶液中OH-的数目0.1NA | |
| C. | 常温常压下,92g NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 甲烷与Cl2光照下反应,主要生成2,4-二氯甲苯 |
7.两种气态烃组成的混合物6.72L(标准状况),完全燃烧生成0.48molCO2和10.8g水,则该混合烃中( )
| A. | 一定不存在乙烯 | B. | 一定不存在甲烷 | C. | 一定存在甲烷 | D. | 一定存在乙烯 |
4.在新制的饱和氯水中,若改变某一条件,下列叙述正确的是( )
| A. | 再通入少量氯气,$\frac{c(O{H}^{-})}{c(HClO)}$减小 | |
| B. | 光照过程中,有气泡冒出,溶液的导电性减弱 | |
| C. | 加入少量的NaHSO3固体,pH增大,溶液漂白性增强 | |
| D. | 加入少量的NaHCO3固体,pH增大,溶液漂白性增强 |
2.用VSEPR模型预测下列分子或离子的立体结构,其中正确的是( )
| A. | H2O与BeCl2为角形(V形) | B. | CS2与SO2为直线形 | ||
| C. | BF3与PCl3为三角锥形 | D. | SO3与CO${\;}_{3}^{2-}$为平面三角形 |