题目内容
5.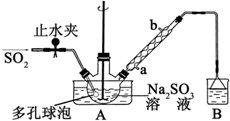 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图:步骤1:在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3溶液.
步骤2:将装置A 中导气管换成橡皮塞.向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤;
步骤3:将滤液真空蒸发浓缩,冷却结晶.
(1)装置B 的烧杯中应加入的溶液是氢氧化钠溶液;冷凝管中冷却水从a(填“a”或“b”)口进水.
(2)A中多孔球泡的作用是增大气体与溶液的接触面积,加快气体的吸收速率.
(3)冷凝管中回流的主要物质除H2O 外还有HCHO (填化学式).
(4)写出步骤2中发生反应的化学方程式NaHSO3+HCHO+Zn+H2O=NaHSO2•HCHO+Zn(OH)2.
(5)步骤3中在真空容器中蒸发浓缩的原因是防止温度过高使产物分解,也防止氧气将产物氧化.
(6)为了测定产品的纯度,准确称取2.0g样品,完全溶于水配成100mL溶液,取20.00mL所配溶液,加入过量碘完全反应后(已知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g,则所制得的产品的纯度为77%.
分析 (1)未反应的二氧化硫气体是酸性氧化物能和碱溶液反应;根据采用逆流冷却效果好判断进水口;
(2)多孔球泡可以增大气体与液体的接触面积;
(3)甲醛易挥发,据此判断回流物质;
(4)步骤2中锌粉和甲醛溶液、NaHSO3溶液发生氧化还原反应生成次硫酸氢钠甲醛和氢氧化锌沉淀;
(5)次硫酸氢钠甲醛具有强还原性,遇到空气中的氧气易被氧化;
(6)根据反应NaHSO2•HCHO•2H2O+2I2=NaHSO4+HI+HCHO和NaHSO4+BaCl2=BaSO4↓+HCl+NaCl得关系式NaHSO2•HCHO•2H2O~BaCl2,可计算得纯NaHSO2•HCHO•2H2O的质量,根据纯度=$\frac{次硫酸氢钠甲醛的质量}{样品的质量}$×100%.
解答 解::(1)实验中未参与反应的二氧化硫气体会通过导气管进入B装置,可以用氢氧化钠溶液吸收二氧化硫乙防止污染空气,根据采用逆流冷却效果好可知进水口为a,
故答案为:氢氧化钠溶液;a;
(2)多孔球泡可以增大气体与液体的接触面积,加快气体的吸收速率,
故答案为:增大气体与溶液的接触面积,加快气体的吸收速率;
(3)HCHO易挥发,在80°C-90°C条件下会大量挥发,所以冷凝管中回流的主要物质除H2O 外还有HCHO,
故答案为:HCHO;
(4)步骤2中锌粉和甲醛溶液、NaHSO3溶液发生氧化还原反应生成次硫酸氢钠甲醛和氢氧化锌沉淀,反应方程式为NaHSO3+HCHO+Zn+H2O=NaHSO2•HCHO+Zn(OH)2,
故答案为:NaHSO3+HCHO+Zn+H2O=NaHSO2•HCHO+Zn(OH)2;
(5)次硫酸氢钠甲醛具有强还原性,遇到空气中的氧气易被氧化,所以步骤3中在真空容器中蒸发浓缩的原因是防止温度过高使产物分解,也防止氧气将产物氧化,
故答案为:防止温度过高使产物分解,也防止氧气将产物氧化;
(6)根据反应NaHSO2•HCHO•2H2O+2I2=NaHSO4+HI+HCHO和NaHSO4+BaCl2=BaSO4↓+HCl+NaCl得关系式NaHSO2•HCHO•2H2O~BaCl2,硫酸钡的质量为0.466g,其物质的量为0.002mol,所以样品中纯NaHSO2•HCHO•2H2O的质量为0.002mol×$\frac{100}{20}$×154g/mol=1.54g,所以纯度=$\frac{次硫酸氢钠甲醛的质量}{样品的质量}$×100%=$\frac{1.54g}{2g}$×100%=77%,
故答案为:77%.
点评 本题考查了实验制备方案的设计,实验步骤的操作,仪器使用方法,反应过程中的物质判断,题目难度中等.

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3,加入萃取剂的目的是除去溶液中的Mn2+.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
| A. | SO2和NO2都是有用的化工原料,因此目前都是将汽车尾气中的氮氧化合物收集后制备硝酸以防止污染空气 | |
| B. | 由于HClO具有漂白性,因此工业上常用Cl2的水溶液来漂白纸浆、毛、丝、草帽辫 | |
| C. | 稀土元素在自然界中含量非常低,难以开采,但它们在冶金工业中有着重要的用途,被称为冶金工业的维生素 | |
| D. | 金属钠通常被保存在煤油或石蜡油中,以隔绝空气 |
| 序号 | 35mL试剂 | 固体 | 混合前 温度/℃ | 混合后 温度/℃ |
| ① | 水 | 2.5g NaHCO3 | 20.0 | 18.5 |
| ② | 水 | 3.2g Na2CO3 | 20.0 | 24.3 |
| ③ | 盐酸 | 2.5g NaHCO3 | 20.0 | 16.2 |
| ④ | 盐酸 | 3.2g Na2CO3 | 20.0 | 25.1 |
| A. | Na2CO3溶液与盐酸的反应是吸热反应 | |
| B. | NaHCO3溶液与盐酸的反应是放热反应 | |
| C. | 20.0℃时,含3.2 g Na2CO3的饱和溶液和35 mL盐酸混合后的温度将低于25.1℃ | |
| D. | 20.0℃时,含2.5 g NaHCO3的饱和溶液和35 mL盐酸混合后的温度将低于16.2℃ |









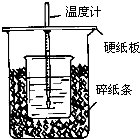 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: