题目内容
17.为探究NaHCO3、Na2CO3和盐酸(以下盐酸浓度均为1mol•L-1)反应过程中的热效应,实验测得如下数据:| 序号 | 35mL试剂 | 固体 | 混合前 温度/℃ | 混合后 温度/℃ |
| ① | 水 | 2.5g NaHCO3 | 20.0 | 18.5 |
| ② | 水 | 3.2g Na2CO3 | 20.0 | 24.3 |
| ③ | 盐酸 | 2.5g NaHCO3 | 20.0 | 16.2 |
| ④ | 盐酸 | 3.2g Na2CO3 | 20.0 | 25.1 |
| A. | Na2CO3溶液与盐酸的反应是吸热反应 | |
| B. | NaHCO3溶液与盐酸的反应是放热反应 | |
| C. | 20.0℃时,含3.2 g Na2CO3的饱和溶液和35 mL盐酸混合后的温度将低于25.1℃ | |
| D. | 20.0℃时,含2.5 g NaHCO3的饱和溶液和35 mL盐酸混合后的温度将低于16.2℃ |
分析 由表中数据可知,NaHCO3溶于水的过程为吸热过程,Na2CO3溶于水的过程为放热过程,NaHCO3与盐酸的反应后温度降低,说明该反应是吸热反应;Na2CO3与盐酸的反应后温度升高,说明该反应是放热反应,以此解答该题.
解答 解:A.由表中数据可知,3.2gNa2CO3加入盐酸中,包括溶解和反应两个过程,其中溶解使温度升高到24.3℃,最终温度为25.1℃,说明Na2CO3与盐酸的反应是放热反应,故A错误;
B.2.5gNaHCO3加入盐酸中,包括溶解和反应两个过程,其中溶解使温度降低到18.5℃,最终温度为16.2℃,说明NaHCO3与盐酸的反应是吸热反应,故B错误;
C.20.0℃时,含3.2gNa2CO3的饱和溶液和35mL盐酸混合,由于缺少溶解的过程,则混合后的温度将低于25.1℃,故C正确;
D.NaHCO3溶于水的过程为吸热过程,20.0℃时,含2.5gNaHCO3的饱和溶液和35mL盐酸混合,与固体相比较,缺少溶解吸热的过程,混合后的温度将高于16.2℃,故D错误;
故选C.
点评 本题考查了探究吸热反应与放热反应的方法,题目难度中等,正确分析题干数据为解答该题的关键,注意溶解热和反应热的区别,试题培养的化学的分析能力及化学实验能力.

练习册系列答案
相关题目
7.对于反应N2(g)+3H2O(g)═2NH3(g)+$\frac{3}{2}$O2(g),在不同时间段内所测反应速率见选项,则表示该化学反应进行最快的是( )
| A. | v(N2)=1.5 mol•(L•min)-1 | B. | v(NH3)=1.8 mol•(L•min)-1 | ||
| C. | v(H2O)=2.67 mol•(L•min)-1 | D. | v(O2)=1.5 mol•(L•min)-1 |
12.当今社会,材料、能源与人们的生活息息相关.下列有关说法错误的是( )
| A. | 奥运场馆“鸟巢”使用的代号为Q460的特殊钢是合金 | |
| B. | 乙醇是可再生的燃料,车用乙醇汽油值得提倡 | |
| C. | 复合材料一般有强度高、质量轻、耐高温、耐腐蚀等优异性能 | |
| D. | 含植物营养元素氮、磷的生活污水有利于水生植物成长,可以净化天然水体 |
2.某中学化学兴趣小组为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量的10%的稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水).有关实验数据如下表:
请计算(写出计算过程):
(1)该石灰石中碳酸钙的质量分数;
(2)参加反应10%的盐酸的质量.
| 反应前 | 反应后 | ||
| 实验 数据 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
| 134.4 g | 10 g | 141.1 g | |
(1)该石灰石中碳酸钙的质量分数;
(2)参加反应10%的盐酸的质量.
9.下列对分子性质的解释中,不正确的是( )
| A. | 已知大多数含氧酸可用通式XOm(OH)n来表示,H2SeO3、HMnO4、H3BO3、H3PO4 四种酸中酸性最强的是H2SeO3 | |
| B. | HF的沸点比H2O低是因水中氢键的键能比氟化氢中氢键能大 | |
| C. | 向加入过量氨水的硫酸铜溶液中加入乙醇,将析出深蓝色晶体来,是因为乙醇分子极性比水小 | |
| D. | H2CO3分子中的非羟基氧的个数为1,然而其酸性较弱,原因是溶于水的二氧化碳分子只有极少数与水结合成碳酸 |
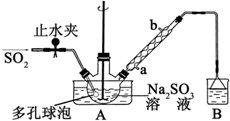 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图: