题目内容
9.根据下列反应:①2FeCl3+2KI═2FeCl2+I2+2KCl
②2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O
③2FeCl2+Cl2═2FeCl3
(1)根据反应判断FeCl3、KMnO4、I2、Cl2的氧化性由强到弱的顺序是KMnO4>Cl2>FeCl3>I2(用“>”连接)
(2)反应②中被氧化的HCl与未被氧化的HCl的质量之比为5:3,现在取250mL 12mol•L-1的浓盐酸与一定量的KMnO4固体充分反应后,测得放出的气体体积为1.12L(标准状况下),此过程中转移的电子数目为0.1NA(用NA表示),若忽略溶液体积变化,反应后溶液中的盐酸的物质的量浓度为11.36mol•L-1(保留两位小数).
(3)在强酸性溶液中将MnO4-、Fe2+、Fe3+、I-四种离子的溶液混合在一起,充分反应后:
①若溶液中有I-剩余,则溶液中一定无MnO4-、Fe3+(填离子符号)
②若溶液中有MnO4-剩余,则溶液中一定无Fe2+、I-(填离子符号)
分析 (1)一般来说,氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;
(2)氧化还原反应中,化合价升高的元素被氧化,对应产物是氧化产物,化合价降低元素被还原,所在的反应物是氧化剂,发生还原反应,对应产物是还原产物;根据化学方程式和转移的电子数目来计算消耗的KMnO4质量和转移电子的量的情况;
(3)MnO4-、Fe3+具有强氧化性,可与具有还原性的I-发生氧化还原反应,且MnO4-、Fe2+发生氧化还原反应.
解答 解:(1)一般来说,氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,①2FeCl3+2KI═2FeCl2+I2+2KCl可知氧化性FeCl3>I2,
②2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O可知氧化性KMnO4>Cl2,③2FeCl2+Cl2═2FeCl3可知氧化性Cl2>FeCl3,则氧化性KMnO4>Cl2>FeCl3>I2,
故答案为:KMnO4>Cl2>FeCl3>I2;
(2)氧化还原反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,化合价降低的Mn元素被还原,所在的反应物KMnO4是氧化剂,在反应的16HCl(浓)中,被氧化的占10mol,未被氧化的HCl为6mol,被氧化与未被氧化的HCl的质量之比为5:3,
测得放出的气体体积为1.12L,则n(Cl2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,反应中Cl元素化合价由-1价升高到0价,则转移电子0.05mol×2=0.1mol电子,数目为0.1NA,
由方程式可知生成0.05mol氯气,消耗0.16molHHCl,则反应后盐酸的物质的量浓度为$\frac{0.25L×12mol/L-0.16mol}{0.25L}$=11.36mol/L.
故答案为:5:3;0.1NA;11.36;
(3)①因I-具有还原性,可与MnO4-、Fe3+发生氧化还原反应,则一定不存在MnO4-、Fe3+,故答案为:MnO4-、Fe3+;
②若溶液中有MnO4-剩余,则溶液中一定无还原性的Fe2+、I-,故答案为:Fe2+、I-.
点评 本题考查较为综合,侧重学生的分析、计算能力的考查,为高频考点,注意把握氧化性的比较角度以及计算的方法,难度不大.

| A. | 醋酸溶液与NaOH反应:OH-+H+→H2O | |
| B. | 硝酸溶液和碳酸氢钠反应:H++2CO32-→CO2↑+H2O | |
| C. | 将溴水加入KI溶液中:Br2+2I-→I2+2Br- | |
| D. | CO2通入澄清石灰水:2OH-+CO2→H2O+CO32- |
| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5 kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-802.3 kJ•mol-1 | |
| C. | 2CO(g)+1O2(g)═2CO2(g)△H=-566 kJ•mol-1 | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 |
| A. | 铁表面涂油漆可增强其抗腐蚀性 | |
| B. | PM2.5是指大气中直径接近2.5×10-6m的颗粒,分散在空气中形成胶体 | |
| C. | 大量燃烧煤、石油等化石燃料是造成雾霾天气的一种重要因素 | |
| D. | 含重金属离子的电镀废液不能随意排放 |
| 选项 | 离 子 | 要 求 |
| A | K+、NO3-、Cl-、SO42- | c(K+)<c(Cl-) |
| B | Ca2+、NO3-、CO32-、Cl- | 逐滴加入盐酸立即有气体产生 |
| C | Na+、Cu2+、Mg2+、SO42- | 逐滴加入NaOH溶液立即有沉淀产生 |
| D | H+、NH4+、Al3+、SO42- | 逐滴加入NaOH溶液立刻有气体产生 |
| A. | A | B. | B | C. | C | D. | D |
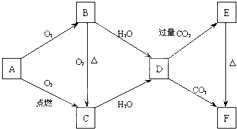 如图所示,A、B、C、D、E、F为金属钠或钠的化合物.
如图所示,A、B、C、D、E、F为金属钠或钠的化合物.