题目内容
17.下列离子方程式正确的是( )| A. | 澄清石灰水与稀盐酸反应:Ca(OH)2+2H+═Ca2++2H20 | |
| B. | 碳酸钠溶液与少量盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| C. | 稀硫酸与氢氧化钡溶液反应:H++OH-+Ba2++SO42-═H2O+BaSO4↓ | |
| D. | 氢氧化铜与稀硫酸反应:Cu(OH)2+2H+═Cu2++2H2O |
分析 A.反应生成氯化钙和水;
B.反应生成碳酸氢钠;
C.不符合离子的配比;
D.反应生成硫酸铜和水.
解答 解:A.澄清石灰水与稀盐酸反应的离子反应为H++OH-═H20,故A错误;
B.碳酸钠溶液与少量盐酸反应的离子反应为CO32-+H+═HCO3-,故B错误;
C.稀硫酸与氢氧化钡溶液反应的离子反应为2H++2OH-+Ba2++SO42-═2H2O+BaSO4↓,故C错误;
D.氢氧化铜与稀硫酸反应的离子反应为Cu(OH)2+2H+═Cu2++2H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
8.有些地区水井中的水刚从井中抽出时是清澈透明的,但烧开后发现产生了红褐色的不溶物.某中学研究性学习小组对这种现象进行了分析:向刚抽出的井水中加入硫氰化钾溶液,无明显现象;向产生不溶物的水中加入盐酸,不溶物溶解,再向其中加入硫氰化钾溶液,溶液呈现血红色.则下列说法不正确的是( )
| A. | 该井水中肯定有Fe3+ | |
| B. | 该井水中肯定有Fe2+ | |
| C. | 红褐色不溶物是Fe(OH)3 | |
| D. | 红褐色不溶物是由于氧化和水解产生 |
9.四种短周期元素在周期表中的位置如图,其中只有M为金属元素,下列说法不正确的是( )
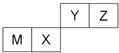

| A. | 原子半径Z<M | |
| B. | Z位于元素周期表中第2周期、第ⅥA族 | |
| C. | X的最简单气态氢化物的热稳定性比Z的小 | |
| D. | X的最高价氧化物不溶于任何酸 |





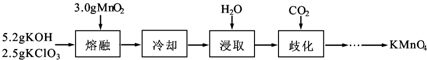
 实验室用MnO2、KOH及KClO3为原料制取高锰酸钾的实验流程如下:
实验室用MnO2、KOH及KClO3为原料制取高锰酸钾的实验流程如下: