题目内容
2.2015年9月18日,美国环保署EPA宣布,大众汽车公司利用软件隐瞒了汽车有毒污染物的真实排放量.汽车尾气中的污染物有固体悬浮微粒、一氧化碳、碳氢化合物、氮氧化合物、铅及硫氧化合物等.下列有关说法正确的是( )| A. | 一氧化碳、氮氧化物是酸雨形成的主要因素 | |
| B. | 汽车尾气可通过净化装置将碳氢化合物还原成CO2和H2O | |
| C. | 含铅化合物导致人体蛋白质变性是物理变化 | |
| D. | 固体悬浮微粒是造成雾霾天气的一种重要因素 |
分析 A.酸雨是大量排放SO2及氮氧化物所致;
B.碳氢化合物氧化生成CO2和H2O;
C.变性是化学变化;
D.霾是微粒悬浮形成的.
解答 解:A.酸雨是大量排放SO2及氮氧化物所致,与排放一氧化碳无关,故A错误;
B.碳氢化合物氧化生成CO2和H2O,不熟还原,故B错误;
C.变性有新物质生成,是化学变化,故C错误;
D.可悬浮微粒是造成雾霾天气的一种重要因素,故D正确.
故选D.
点评 本题考查环境污染及治理,为高频考点,侧重于化学与生活、生产、能源与环境的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大,注意相关基础知识的积累.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
8.以下是人们对原子结构的认识所经历的几个重要历史阶段:
①道尔顿提出的原子论;②汤姆孙提出的葡萄干面包原子模型;
③古希腊哲学家德谟克里特的古典原子论;④卢瑟福的原子结构行星模型.
其中先后顺序正确的是( )
①道尔顿提出的原子论;②汤姆孙提出的葡萄干面包原子模型;
③古希腊哲学家德谟克里特的古典原子论;④卢瑟福的原子结构行星模型.
其中先后顺序正确的是( )
| A. | ①③②④ | B. | ③②①④ | C. | ③①④② | D. | ③①②④ |
9.下列叙述正确的是( )
| A. | NaCl的摩尔质量是58.5 g | |
| B. | 含1 mol NaCl的溶液中约含有6.02×1023个Cl- | |
| C. | 1 mol NaCl的质量是58.5 g•mol-1 | |
| D. | 58.5 g NaCl所含Na+和Cl-共1mol |
13.下列各组物质中化学键的类型相同的是( )
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O CO2 | ||
| C. | CaCl2 NaOH H2O | D. | NH3 H2O CO2 |
7.铁及其化合物在日常生活、生产中应用广泛.
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的.按要求回答下列问题:
高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3X+5H2O,则X的化学式NaCl.
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
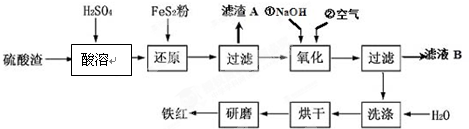
①酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
“滤渣A”主要成份的化学式为SiO2.
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8,如果pH过大,可能引起的后果是Al3+、Mg2+形成沉淀,使制得的铁红不纯(几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式)Na2SO4、Al2(SO4)3、MgSO4.
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的.按要求回答下列问题:
高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3X+5H2O,则X的化学式NaCl.
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:

①酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
“滤渣A”主要成份的化学式为SiO2.
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8,如果pH过大,可能引起的后果是Al3+、Mg2+形成沉淀,使制得的铁红不纯(几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式)Na2SO4、Al2(SO4)3、MgSO4.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
11.下列各组中两种气体的分子数一定相等的是( )
| A. | 温度相同、体积相同的O2和N2 | B. | 质量相等、密度不等的N2和C2H4 | ||
| C. | 体积相同、密度相等的CO和N2O | D. | 压强相同、体积相同的O2和H2 |
12.将足量的铜屑加入到100mL浓度均为2mol.L-1的HNO3和H2SO4的混合溶液中,充分反应后,转移电子的物质的量为( )
| A. | 0.45mol | B. | 0.8mol | C. | 0.6mol | D. | 0.4mol |