题目内容
2.氨在工农业生产中应用广泛.如图Ⅰ所示曲线a为298K、101KPa时N2与H2反应过程中能量变化曲线,图2表示该反应在不同温度下氨的物质的量随时间变化的曲线.
(1)根据图1写出合成氨的热化学方程式N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1.
(2)图1中改变某条件后,由曲线a变成曲线b,则改变的条件是.
(3)根据图2判断T1和T2温度下的平衡常数大小关系是K1> K2(填“>”、“<”或“=”).
(4)N2H4可视为NH3分子中的H被-NH2取代的产物.发射卫星的火箭以N2H4(g)为燃料、NO2为氧化剂,二者反应生成N2和H2O(g).
已知:N2(g)+2O2(g)=2NO2(g)△H1=+67.7kJ•mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ•mol-1.
则:6.4g N2H4与足量NO2完全反应时放出的热量为113.57KJ.
分析 (1)图象分析可知是1molN2与和3molH2完全反应生成2molNH3,反应是放热反应,反应的焓变△H=508kJ/mol-600kJ/mol=-92kJ/mol,据此写出反应的热化学方程式;
(2)由曲线a变成曲线b,反应的活化能降低,反应的热效应不变;
(3)T1和T2相比,温度T2下到达平衡的时间更短,故反应速率更快,故温度T2更高,通过比较温度对平衡的影响来分析对平衡常数的影响;
(4)依据热化学方程式的意义和盖斯定律的内容通过合并计算得到热化学方程式.
解答 解:(1)图象分析可知,图象中表示的是1molN2与和3molH2氧气完全反应生成2molNH3,反应是放热反应,反应的焓变△H=508kJ/mol-600kJ/mol=-92kJ/mol,反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1 ,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1.
(2)由曲线a变成曲线b,反应的活化能降低,反应的热效应不变,故改变的条件是使用了催化剂,故答案为:使用了催化剂;
(3)T1和T2相比,温度T2下到达平衡的时间更短,故反应速率更快,故温度T2更高,而由于此反应放热,温度越高,则平衡左移,平衡常数减小,故T1和T2温度下的平衡常数大小关系是K1>K2,故答案为:>;
(4)①N2(g)+O2(g)=2NO2(g)△H1=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ/mol
依据盖斯定律:②×2-①得到:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol,而6.4gN2H4的物质的量为0.2mol,故与足量NO2完全反应时放出的热量为Q=113.57KJ,故答案为:113.57KJ.
点评 本题考查了热化学方程式的书写方法和盖斯定律的计算应用,应注意的是对于放热反应,升高温度,平衡左移,则平衡常数减小,反之增大,题目较简单.

| A. | 该溶液中SO42-的浓度为0.1mol•L-1 | |
| B. | 该溶液中SO42-的物质的量为0.1mol | |
| C. | 与16.0gCuSO4溶于1L水中所得溶液的浓度相等 | |
| D. | 与16.0gCuSO4•5H2O溶于水中,然后稀释至1L所得溶液的浓度相等 |
| A. | 大气中PM2.5比表面积大,吸附力强,能吸附许多有毒、有害物质 | |
| B. | 氯气分别和氢氧化钠溶液、石灰乳反应得到的所有含氯化合物都具有漂白性 | |
| C. | 石墨烯是一种由单层碳原子构成的新纳米材料,具有导电性 | |
| D. | 刚玉、红宝石主要成分是氧化铝,陶瓷、分子筛主要成分是硅酸盐 |

| A. | 若a为锌块,铁片腐蚀加快 | |
| B. | 若a为石墨,铁片被保护 | |
| C. | 若a为石墨,a上电极反应为O2+2H2O+4e-=4OH- | |
| D. | 若a为锌块,铁片上电极反应为2H++2e-=H2↑ |
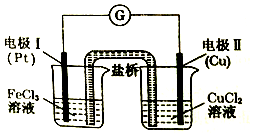
| A. | 盐桥中装有含氯化钾的琼脂,K+移向左池,Cl-移向右池 | |
| B. | 电极I上发生还原反应,电极反应式:Fe3++3e-=Fe | |
| C. | 电极Ⅱ作负极,铜电极逐渐溶解 | |
| D. | 该原电池的总反应为2 Fe3++Cu=Cu2++2Fe2+ |
| A. | 浓硝酸在常温下光照和受热都会分解 | |
| B. | 浓硝酸与金属反应不放出氢气,而稀硝酸与金属反应可置换出氢气 | |
| C. | 常温下,因为铝和铁不与浓硝酸反应,所以浓硝酸可盛放在铝制或铁制容器中 | |
| D. | 铜分别与浓硝酸、稀硝酸反应生成NO2和NO,故稀硝酸的氧化性大于浓硝酸 |
| A. | 沸水中滴入FeCl3饱和溶液:Fe3++3H2O$\frac{\underline{\;△\;}}{\;}$Fe(OH)3↓+3H+ | |
| B. | 氯气和水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 用氢氧化钠溶液吸收过量二氧化碳:OH-+CO2═HCO${\;}_{3}^{-}$ | |
| D. | Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
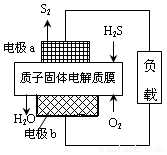 工业废气H2S经资源化利用后可回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJ•mol-1.H2S燃料电池的工作原理如图所示.下列说法不正确的是( )
工业废气H2S经资源化利用后可回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJ•mol-1.H2S燃料电池的工作原理如图所示.下列说法不正确的是( )| A. | 电极a为电池的正极 | |
| B. | 电极b上发生的电极反应为O2+4H++4e-=2H2O | |
| C. | 若电路中通过2mol电子,则电池内部释放632kJ热能 | |
| D. | 若有17gH2S参与反应,则会有1molH+经质子膜进入正极区 |
| A. | 臭氧的摩尔质量是48g | |
| B. | 同温同压条件下,等质量的氧气和臭氧体积比为2:3 | |
| C. | 16g臭氧中含有6.02×1023个原子 | |
| D. | l.00mol臭氧中含有电子总数为18×6.02×1023个 |