题目内容
8.一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)═CH3OCH3(g)+H2O(g)| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
| A. | 该反应的正方应为吸热反应 | |
| B. | 达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小 | |
| C. | 容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长 | |
| D. | 若起始时向容器Ⅰ中充入CH3OH 0.15 mol、CH3OCH3 0.15 mol 和H2O 0.10 mol,则反应将向正反应方向进行 |
分析 A.对比I、Ⅲ可知,升高温度CH3OCH3(g)的物质的量减小,说明平衡逆向移动,而升高温度平衡向吸热反应移动;
B.Ⅱ等效为Ⅰ中平衡基础上压强增大一倍,反应气体体积不变,平衡不移动;
C.温度越高,反应速率越快;
D.根据I中数据计算平衡常数,计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行.
解答 解:A.对比I、Ⅲ可知,升高温度CH3OCH3(g)的物质的量减小,说明平衡逆向移动,而升高温度平衡向吸热反应移动,则正反应为放热反应,故A错误;
B.Ⅱ等效为Ⅰ中平衡基础上压强增大一倍,反应气体体积不变,平衡不移动,容器Ⅰ中的CH3OH体积分数与容器Ⅱ中的相等,故B错误;
C.I中温度高,反应速率快,到达平衡时间更短,故C错误;
D.容器Ⅰ中平衡时c(CH3OCH3)=c(H2O)=$\frac{0.08mol}{1L}$=0.080mol/L,c(CH3OH)$\frac{0.2mol-0.08mol×2}{1L}$=0.04mol/L,容器Ⅰ中化学平衡常数K1=$\frac{0.08×0.08}{0.0{4}^{2}}$=4,此时浓度商Qc=$\frac{0.15×0.1}{0.1{5}^{2}}$=0.67<K=4,反应向正反应进行,故D正确,
故选:D.
点评 本题考查化学平衡影响因素、反应速率影响因素、平衡常数及其应用等,侧重考查学生分析解决问题的能力,难度中等.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
18.某有机物的结构如图所示,下列说法正确的是( )


| A. | 与乙苯互为同系物 | B. | 分子中共直线的原子最多有4个 | ||
| C. | 分子中共平面的碳原子最多有13个 | D. | 与甲苯互为同分异构体 |
19.卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)卤族元素位于元素周期表的P区;溴的价电子排布式为4s24p5.
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是碘(写出名称).
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图1的Ⅰ、Ⅱ所示: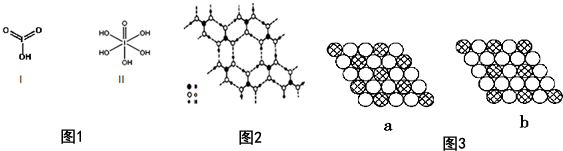
请比较二者酸性强弱:HIO3> H5IO6(填“>”、“<”或“=”).
(5)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3B03分子间通过氢键相连(如图2).则1molH3BO3的晶体中有3 mol氢键.
硼酸溶于水生成弱电解质一水合硼酸B(OH)3•H2 O,它电离生成少量[B(OH)4]一和H+,则[B(OH)4]一含有的化学键类型为共价键、配位键.
(6)如图所示的二维平面晶体示意图3中表示化学式为AX3的是b.
(1)卤族元素位于元素周期表的P区;溴的价电子排布式为4s24p5.
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是碘(写出名称).
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |

请比较二者酸性强弱:HIO3> H5IO6(填“>”、“<”或“=”).
(5)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3B03分子间通过氢键相连(如图2).则1molH3BO3的晶体中有3 mol氢键.
硼酸溶于水生成弱电解质一水合硼酸B(OH)3•H2 O,它电离生成少量[B(OH)4]一和H+,则[B(OH)4]一含有的化学键类型为共价键、配位键.
(6)如图所示的二维平面晶体示意图3中表示化学式为AX3的是b.
16.下列有机分子中,所有的原子不可能处于同一平面的是( )
| A. | CH2=CH-C≡N | B. | CH2=CH-CH=CH2 | C. |  | D. |  |
13.下列化合物不能通过化合反应获得的是( )
| A. | Fe(OH)3 | B. | CaSiO3 | C. | Al(OH)3 | D. | NaHCO3 |
20.下列五种有色溶液与SO2作用,均能褪色,其反应实质相同的是( )
①品红溶液②酸性KMnO4溶液③溴水④滴入酚酞的烧碱溶液⑤淀粉-碘溶液.
①品红溶液②酸性KMnO4溶液③溴水④滴入酚酞的烧碱溶液⑤淀粉-碘溶液.
| A. | ①②③ | B. | ②③④ | C. | ③④⑤ | D. | ②③⑤ |
3.关于同温同压下等体积CO2和CO的叙述:①质量相等 ②密度相等 ③所含分子数相等 ④所含碳原子数相等. 其中正确的是( )
| A. | ①②③④ | B. | ②③④ | C. | ③④ | D. | ③ |
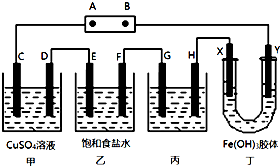 某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题: 在稀硫酸、纯碱、二氧化碳、铜片、食盐、生石灰、三氧化钨、铁片和木炭粉9种物质中,存在下面的相互关系,选择①~⑤为适当的物质,使有连线的两种物质能发生反应.
在稀硫酸、纯碱、二氧化碳、铜片、食盐、生石灰、三氧化钨、铁片和木炭粉9种物质中,存在下面的相互关系,选择①~⑤为适当的物质,使有连线的两种物质能发生反应.