题目内容
4.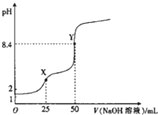 用0.1mot•L-1的NaOH溶液滴定25mL0.1mol•L-1 H2C2O4(草酸)溶液的滴定曲线如图所示,下列说法不正确的是( )
用0.1mot•L-1的NaOH溶液滴定25mL0.1mol•L-1 H2C2O4(草酸)溶液的滴定曲线如图所示,下列说法不正确的是( )| A. | 草酸是弱酸 | |
| B. | X点:c(H2C2O4)+c(HC2O4-)=c (Na+)-c(C2O42-) | |
| C. | Y 点:c(H2C2O4)+c(HC2O4-)=c(OH-)-C(H+) | |
| D. | 滴定过程中始终存在:c(OH-)+2c(C2O42-)+c(HC2O4-)=c(Na+)+c(H+) |
分析 A.由图可知,25mL0.1mol•L-1的H2C2O4的pH大于1;
B.X点:溶液中溶质为NaHC2O4,根据物料守恒分析;
C.Y点:溶液中溶质为Na2C2O4,根据电荷守恒和物料守恒分析;
D.根据溶液中的电荷守恒分析.
解答 解:A.由图可知,25mL0.1mol•L-1的H2C2O4的pH大于1,说明H2C2O4部分电离,是弱酸,故A正确;
B.X点:溶液中溶质为NaHC2O4,溶液中物料守恒为c(H2C2O4)+c(HC2O4-)+c(C2O42-)=c (Na+),则c(H2C2O4)+c(HC2O4-)=c (Na+)-c(C2O42-),故B正确;
C.Y点:溶液中溶质为Na2C2O4,溶液中物料守恒为2c(H2C2O4)+2c(HC2O4-)+2c(C2O42-)=c (Na+),溶液中电荷守恒为c(OH-)+2c(C2O42-)+c(HC2O4-)=c(Na+)+c(H+),联立两个式子消去c (Na+),可得:2c(H2C2O4)+c(HC2O4-)=c(OH-)-C(H+),故C错误;
D.滴定过程中始终存在OH-、C2O42-、HC2O4-、Na+、H+,溶液中的电荷守恒为c(OH-)+2c(C2O42-)+c(HC2O4-)=c(Na+)+c(H+),故D正确.
故选C.
点评 本题考查了酸碱混合时溶液定性判断及溶液酸碱性与溶液pH的关系,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,根据电荷守恒、物料守恒分析解答,侧重于考查学生的分析能力和应用能力.

练习册系列答案
相关题目
9.X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:
(1)Q在元素周期表中的位置是第二周期VIA族.
(2)周期表中有些处于对角(左上→右下)位置的元素,它们的单质及其化合物的性质存在“对角线相似”的现象,则M的氧化物与强碱溶液反应的离子方程式是BeO+2OH-=BeO22-+H2O.
(3)Q和R按原个数比1:1组成的化合物甲是一种“绿色”氧化剂.甲中所含共价键类型是极性键、非极性键.
(4)Z与Q的最简单氢化物中沸点较高的是H2O(填化学式),原因是H2O分子之间存在氢键作用.
| 元素代号 | X | Y | Z | M | Q | R |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.037 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
(2)周期表中有些处于对角(左上→右下)位置的元素,它们的单质及其化合物的性质存在“对角线相似”的现象,则M的氧化物与强碱溶液反应的离子方程式是BeO+2OH-=BeO22-+H2O.
(3)Q和R按原个数比1:1组成的化合物甲是一种“绿色”氧化剂.甲中所含共价键类型是极性键、非极性键.
(4)Z与Q的最简单氢化物中沸点较高的是H2O(填化学式),原因是H2O分子之间存在氢键作用.
10.短周期元素X和Y,可组成化合物XY3.当X的原子序数为a时,Y的原子序数可能是:①a+2,②a+4,③a+8,④a+12,⑤a-6,其中正确的组合是( )
| A. | ①② | B. | ①②③ | C. | ①②③⑤ | D. | ①②④⑤ |
7.下列说法不正确的是( )
| A. | 通过对苯燃烧和甲烷燃烧现象的对比,可以判断两种物质中含碳量的高低 | |
| B. | 苯不能使酸性高锰酸钾溶液褪色,说明苯分子中没有碳碳双键 | |
| C. | 甲烷分子是空间正四面体形,苯分子是平面形 | |
| D. | 苯不能与Br2(CCl4)发生加成反应,故苯为饱和烃 |
14.下列实验操作能达到预期实验目的是( )
| 实验目的 | 实验操作 | |
| A | 检验FeCl3溶液的Fe2+ | 向溶液中加入酸性KMnO4溶液 |
| B | 比较CH3COOH和HCN的酸性强弱 | 用pH计分别测定CH3COONa、NaCN饱和溶液的pH |
| C | 制备H2SiO3胶体 | 向Na2SiO3溶液中滴加过量HCl |
| D | 除去乙酸乙酯中的CH3COOH | 加入饱和Na2CO3溶液,振荡后静置,分液 |
| A. | A | B. | B | C. | C | D. | D |
9.下列离子方程式书写正确的是( )
| A. | 氧化铁与稀硫酸反应:Fe2O3+6H+═Fe2++3H2O | |
| B. | 石灰石溶于盐酸中:CO32-+2H+═CO2↑+H2O | |
| C. | 硫酸铜溶液与氢氧化钠溶液混合:Cu2++2OH-═Cu(OH)2↓ | |
| D. | 碳酸氢钙溶液与盐酸反应:HCO3-+H+═H2O+CO2↑ |
16.Fe、Fe2O3、Fe3O4的混合物中,加入100ml 2mol/L的硫酸,恰好使混合物完全溶解,所得溶液中,加入KSCN溶液无血红色出现,若用足量的CO在高温下还原相同质量的此混合物,能得到的铁的质量为( )
| A. | 22.4g | B. | 11.2g | C. | 5.6g | D. | 无法计算 |
13.已知还原性:SO32->I-.某溶液X可能含有NH4+、Na+、Ba2+、Fe3+、I-、SO32-、SO42-中的几种,为确定其组成,某同学进行如图实验:下列说法正确的是( )
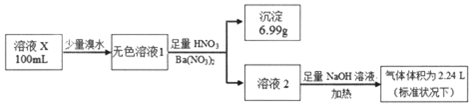

| A. | 溶液X肯定只存在NH4+、SO42- | |
| B. | 溶液X一定不含有Ba2+、Fe3+,可能含有I- | |
| C. | 为确定可能存在的阴离子,可另取试液滴加足量盐酸、BaCl2溶液 | |
| D. | 为确定可能存在的阳离子,可用经过稀硫酸洗过的铂丝蘸取溶液X在酒精灯火焰上灼烧 |
14.下列物质属于纯净物的是( )
| A. | 铝热剂 | B. | 福尔马林 | C. | 干冰 | D. | 碘酒 |