题目内容
11.已知X、Y、Z三元素原子电子层数相同,X元素最高价氧化物的水化物是强碱,Y元素的最高价氧化物的水化物具有两性,Z元素的最高价氧化物的水化物是一种强酸,则X、Y、Z三种元素的原子序数由大到小的顺序正确的是( )| A. | X>Y>Z | B. | Y>X>Z | C. | Y>Z>X | D. | Z>Y>X |
分析 X、Y、Z三种元素原子具有相同的电子层数,则三元素处于同一周期,X元素最高价氧化物的水化物是强碱,Y元素的最高价氧化物的水化物具有两性,Z元素的最高价氧化物的水化物是一种强酸,则X、Y为金属,Z为非金属,同一周期随原子序数增大,金属性减弱,非金属性增强,以此解答该题.
解答 解:X、Y、Z三种元素原子具有相同的电子层数,则三元素处于同一周期,X元素最高价氧化物的水化物是强碱,Y元素的最高价氧化物的水化物具有两性,Z元素的最高价氧化物的水化物是一种强酸,则X为活泼金属,Y的金属性较X弱,Z为非金属,同一周期随原子序数增大,金属性减弱,非金属性增强,所以原子序数Z>Y>X,
故选D.
点评 本题考查元素周期律与位置关系,为高频考点,侧重考查学生的分析能力,难度不大,关键判断金属性与非金属性的递变,来确定元素的相对位置.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
2.某课外活动小组的同学进行探究银氨溶液温度对丙醛的银镜反应生成速率的影响.实验操作步骤简述如下:
1.准备好实验药品;2.准备好实验仪器;3.配制银氨溶液;4.进行银氨溶液温度对丙醛的银镜反应生成速率的影响探究实验.
请回答下列问题:
(1)丙醛发生银镜反应的化学方程式为:CH3CH2CHO+2Ag(NH3)2OHCH3CH2COONH4+2Ag↓+3NH3+H2O.
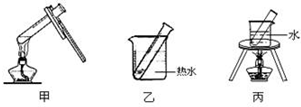
(2)银镜反应选择的加热方法是乙(填下列装置编号).
(3)该兴趣小组的同学探究银氨溶液的温度对丙醛的银镜反应生成速率的影响.参照下表格,在实验前拟定好实验记录表格,完整体现实验方案(只列出需记录物理量和单位,不用填写实验数据):
(4)实验完清洗试管内壁附着的银镜方法是:先用稀HNO3溶解,然后再用水清洗
(5)你认为探究丙醛进行银镜反应的最佳条件,除了测定银镜出现的时间外,还需要比较不同条件下形成的银镜的光亮程度.
1.准备好实验药品;2.准备好实验仪器;3.配制银氨溶液;4.进行银氨溶液温度对丙醛的银镜反应生成速率的影响探究实验.
请回答下列问题:
(1)丙醛发生银镜反应的化学方程式为:CH3CH2CHO+2Ag(NH3)2OHCH3CH2COONH4+2Ag↓+3NH3+H2O.
(2)银镜反应选择的加热方法是乙(填下列装置编号).

(3)该兴趣小组的同学探究银氨溶液的温度对丙醛的银镜反应生成速率的影响.参照下表格,在实验前拟定好实验记录表格,完整体现实验方案(只列出需记录物理量和单位,不用填写实验数据):
| 实验变量 实验序号 | 银氨溶液的量/mL | |||
| 1 | ||||
| 2 |
(5)你认为探究丙醛进行银镜反应的最佳条件,除了测定银镜出现的时间外,还需要比较不同条件下形成的银镜的光亮程度.
6.下列有机物相关描述不正确的( )
| A. | 合成顺丁橡胶(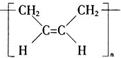 )的单体是CH2=CH-CH=CH2 )的单体是CH2=CH-CH=CH2 | |
| B. | 甲醇、乙二醇、丙三醇都为饱和醇,熔沸点依次递增 | |
| C. | 1mol 绿原酸  通过消去反应脱去1 molH2O时,能得到6 种不同产物(不考虑立体异构) 通过消去反应脱去1 molH2O时,能得到6 种不同产物(不考虑立体异构) | |
| D. | 0.1 mol的 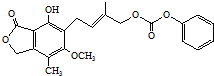 最多能与含0.5 molNaOH的水溶液完全反应 最多能与含0.5 molNaOH的水溶液完全反应 |
16.下列说法不正确的是( )
①质子数相同的粒子一定属于同种元素;②同位素的性质几乎完全相同;③质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子;④电子数相同的粒子不一定是同一种元素;⑤一种元素只能有一种质量数:⑥某种元素的相对原子质量取整数,就是其质量数.⑦Cl2中35Cl与37Cl的原子个数之比与HCl中的35Cl与37Cl的原子个数之比相等.
①质子数相同的粒子一定属于同种元素;②同位素的性质几乎完全相同;③质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子;④电子数相同的粒子不一定是同一种元素;⑤一种元素只能有一种质量数:⑥某种元素的相对原子质量取整数,就是其质量数.⑦Cl2中35Cl与37Cl的原子个数之比与HCl中的35Cl与37Cl的原子个数之比相等.
| A. | ②③⑤⑥⑦ | B. | ①②④⑤ | C. | ①②⑤⑥ | D. | ③④⑥⑦ |
3.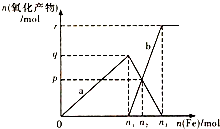 含有4molHNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示.下列有关判断不正确的是( )
含有4molHNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示.下列有关判断不正确的是( )
 含有4molHNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示.下列有关判断不正确的是( )
含有4molHNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示.下列有关判断不正确的是( )| A. | a是Fe(NO3)3 | B. | n1=1 | C. | p=1.2 | D. | n3=1.5 |
20.钠及其化合物具有广泛的用途.
(1)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如表;
上述盐溶液中,结合H+能力最强的阴离子是CO32-,根据表中数据,浓度均为0.01mol•L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是C(填编号).
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)实验室中常用NaOH来进行洗气和提纯.
①当300mL 1mol•L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为C(Na+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+).
②几种离子开始沉淀时的pH如表:
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,Cu2+(填离子符号)先沉淀,KSP[Fe(OH)2]<KSP[Mg(OH)2](填“>”、“=”或“<”).
(1)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如表;
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)实验室中常用NaOH来进行洗气和提纯.
①当300mL 1mol•L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为C(Na+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+).
②几种离子开始沉淀时的pH如表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
1.当有机物分子中的一个碳原子所连四个原子或原子团均不相同时,此碳原子就是“手性碳原子”,具有手性碳原子的物质存在对映异构体,如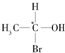 等,则下列化合物中存在对映异构体的是( )
等,则下列化合物中存在对映异构体的是( )
 等,则下列化合物中存在对映异构体的是( )
等,则下列化合物中存在对映异构体的是( )| A. | CH3COOH | B. | CH3COCH3 | ||
| C. | 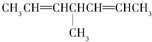 | D. | 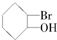 |
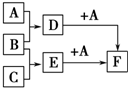 已知A、B、C是三种常见的单质,其中A为固体,B、C为气体;D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色;B和C反应的产物极易溶于水得无色溶液E.它们之间转化关系如图所示.
已知A、B、C是三种常见的单质,其中A为固体,B、C为气体;D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色;B和C反应的产物极易溶于水得无色溶液E.它们之间转化关系如图所示.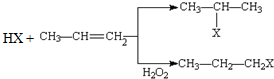 (X为卤素原子)
(X为卤素原子)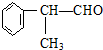 的物质,该物质是一种香料.
的物质,该物质是一种香料.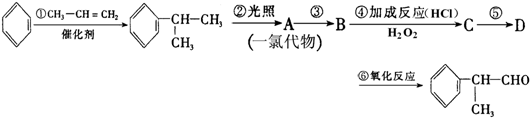
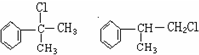 ;
;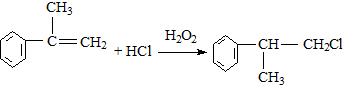 ;
;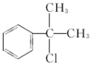 的水解产物
的水解产物 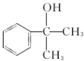 ,不能被氧化生成D,若直接转化为D则会降低D的产率与纯度;
,不能被氧化生成D,若直接转化为D则会降低D的产率与纯度; 等任意一种.
等任意一种.