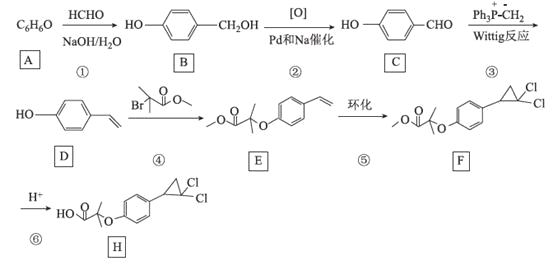
题目内容
【题目】以下为某学习小组探究用硫酸钙和焦炭在高温下反应制备硫化钙并检验产物的实验装置。
(1)甲同学设计如图所示的实验装置检验气体产物。
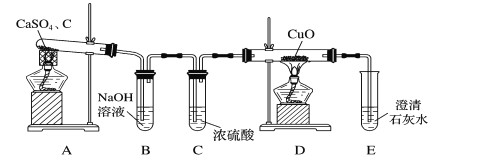
①B装置的作用是___。
②D和E装置能检验装置A的反应产物中有气体__(填化学式),能说明产生有该气体的现象是__。
(2)乙同学根据氧化还原反应原理,提出装置A产生的气体产物中可能还有CO2、SO2,为了验证他的猜想,结合上述装置并选择下列仪器设计实验方案(同一种仪器可重复使用)。
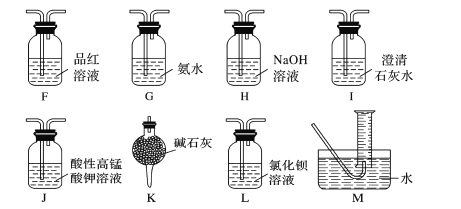
①气流从左至右,仪器连接顺序为A、F、__、M。
②能证明有CO2的现象是__。
③除去SO2的离子方程式为__。
(3)经实验检验气体产物有SO2、CO、CO2且气体体积之比为1∶1∶2,写出A中反应的化学方程式:__。
【答案】除去酸性气体 CO 黑色氧化铜变红,澄清石灰水变浑浊 J、F、I 第二个F中的品红不退色,I中的澄清石灰水变浑浊 5SO2+MnO4-+2H2O=2Mn2++5SO42-+4H+ 2CaSO4+3C![]() CaS+CaO+SO2↑+CO↑+2CO2↑
CaS+CaO+SO2↑+CO↑+2CO2↑
【解析】
硫酸钙和焦炭在高温下反应制备硫化钙的方程式里可能产生使氧化铜还原的气体应为CO,CuO氧化CO生成红色的Cu和CO2,CO2使石灰水变浑浊。验证A中的气体产物可能还有CO2、SO2,必须先用品红验证SO2后再用酸性高锰酸钾除去SO2,再用澄清石灰水检验CO2。根据检验气体产物有SO2、CO、CO2且气体体积之比为1:1:2,写出方程式:2CaSO4+3C![]() CaS+CaO+SO2↑+2CO2↑+CO↑,据此分析解答。
CaS+CaO+SO2↑+2CO2↑+CO↑,据此分析解答。
(1) ①硫酸钙和焦炭在高温下反应制备硫化钙的反应中可能产生使氧化铜还原的气体应为CO,除此之外还可能有CO2、SO2等,会干扰CO的检验,因此氢氧化钠溶液可吸收除去酸性气体,排除对CO检验的干扰;
②通过一氧化碳还原,氧化铜由黑色变红色,生成的CO2能够使澄清石灰水变浑浊,说明装置A的反应产物是CO;
(2)①装置A中的气体产物可能含有SO2和CO2,根据装置图,可以通过品红溶液检验二氧化硫,除去二氧化硫后再用澄清石灰水检验二氧化碳,因此气流从左到右的仪器连接顺序为A、F、J、F、I、M;
②能证明有二氧化碳的现象是第二个F中品红不退色,I中的澄清石灰水变浑浊;
③装置J中酸性高锰酸钾将二氧化硫氧化,反应的离子方程式为5SO2+MnO4-+2H2O=2Mn2++5SO42-+4H+;
(3)经实验检验气体产物有SO2、CO、CO2且气体体积之比为1∶1∶2,反应的化学方程式为2CaSO4+3C=高温CaS+ CaO+ SO2↑+CO↑+2CO2↑。

【题目】二正丁基锡羧酸酯是一种良好的大肠杆菌,枯草杆菌的杀菌剂。合成一种二正丁基锡羧酸酯的方法如图1:

将0.45g的2-苯甲酰基苯甲酸和0.500g的二正丁基氧化锡加入到50mL苯中,搅拌回流分水6小时。水浴蒸出溶剂,残留物经重结晶得到白色针状晶体。
各物质的溶解性表
物质 | 水 | 苯 | 乙醇 |
2-苯甲酰基苯甲酸 | 难溶 | 易溶 | 易溶 |
二正丁基氧化锡 | 难溶 | 易溶 | 易溶 |
正丁基锡羧酸酯 | 难溶 | 易溶 | 易溶 |
回答下列问题:
(1)仪器甲的作用是___,其进水口为___。
(2)实验不使用橡胶塞而使用磨口玻璃插接的原因是___。
(3)分水器(乙)中加蒸馏水至接近支管处,使冷凝管回流的液体中的水冷凝进入分水器,水面上升时可打开分水器活塞放出,有机物因密度小,位于水层上方,从分水器支管回流入烧瓶。本实验选用的分水器的作用是__(填标号)
A.能有效地把水带离反应体系,促进平衡向正反应方向移动
B.能通过观察水面高度不再变化的现象,判断反应结束的时间
C.分离有机溶剂和水
D.主要起到冷凝溶剂的作用
(4)回流后分离出苯的方法是__。
(5)分离出苯后的残留物,要经重结晶提纯,选用的提纯试剂是__(填标号)
A.水 B.乙醇 C.苯
(6)重结晶提纯后的质量为0.670g,计算二正丁基锡羧酸酯的产率约为__。
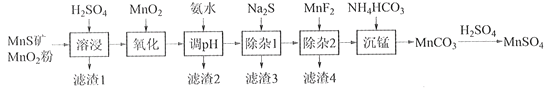
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnz2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___________。
时,z=___________。