题目内容
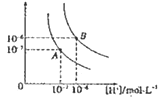
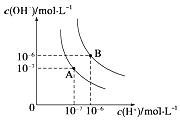
【题目】水的电离平衡曲线如图所示,若A点、B点分别表示25℃和100℃时水的电离达平衡时的离子浓度。则表示25℃的是________(填“A”或“B”)。100℃时,在1molL﹣1的NaOH溶液中,由水电离出的c(H+)=________molL﹣1 。 100℃时,5×10﹣5 molL﹣1的H2SO4溶液与pH=9的Ba(OH)2溶液混合后pH=7,则混合前H2SO4溶液与Ba(OH)2溶液的体积比为________。
【答案】A 1×10﹣12 9:1
【解析】
根据c(OH-)=c(H+)=1×10﹣7 mol·L-1,得出25℃的点;根据100℃时水的离子积常数,得出水电离出的氢离子浓度;100℃时,先求H2SO4溶液c(H+)和Ba(OH)2溶液的c(OH-),再根据混合后呈碱性进行计算。
A点c(OH-)=c(H+)=1×10﹣7 mol·L-1,则表示25℃的是A;100℃时,c(OH-)=c(H+)=1×10﹣6 mol·L-1,在1molL﹣1的NaOH溶液中,由水电离出的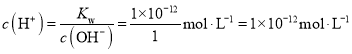 ;100℃时,5×10﹣5 molL﹣1的H2SO4溶液中c(H+)=5×10﹣5 molL﹣1×2=1×10﹣4 mol·L-1,pH=9的Ba(OH)2溶液中c(OH-)= 1×10﹣3 mol·L-1,混合后pH=7,溶液呈碱性,c(OH-)=1×10﹣5 mol·L-1,
;100℃时,5×10﹣5 molL﹣1的H2SO4溶液中c(H+)=5×10﹣5 molL﹣1×2=1×10﹣4 mol·L-1,pH=9的Ba(OH)2溶液中c(OH-)= 1×10﹣3 mol·L-1,混合后pH=7,溶液呈碱性,c(OH-)=1×10﹣5 mol·L-1,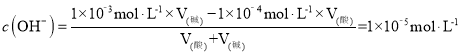 ,
,![]() ,即混合前H2SO4溶液与Ba(OH)2溶液的体积比为9:1,故答案为:A;1×10﹣12;9:1。
,即混合前H2SO4溶液与Ba(OH)2溶液的体积比为9:1,故答案为:A;1×10﹣12;9:1。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】用如图所示装置检验对应气体时,不能达到目的是
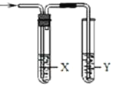
(X—除杂装置、Y—检验装置)
实验目的 | 试剂X | 试剂Y | |
A | 检验溴蒸汽中混有的NO2 | CCl4试剂 | 石蕊试液 |
B | 检验HI中混有的HCl | 饱和NaCl溶液 | AgNO3溶液 |
C C | 浓盐酸与MnO2共热制取的氯气 | NaOH溶液 | 淀粉KI溶液 |
D | C2H5OH与浓H2SO4加热至170℃制取的乙烯 | NaOH溶液 | Br2的CCl4溶液 |
A.AB.BC.CD.D