题目内容
18.已知:①次磷酸(H3PO2)是一种一元弱酸;②常温下,电离平衡常数Ka(H3PO2)=5.9×10-2,Ka(CH3COOH)=1.8×10-5;
(1)下列说法正确的是AD.
A.次磷酸的电离方程式为:H3PO2?H++H2PO2-
B.NaH2PO2属于酸式盐
C.浓度均为0.1mol•L-1的次磷酸(H3PO2)与盐酸相比前者导电能力强
D.0.1mol•L-1NaH2PO2溶液的pH比0.1mol•L-1CH3COONa溶液的pH小
(2)次磷酸钠NaH2PO2具有强还原性,是一种很好的化学镀剂.如NaH2PO2能将溶液中的Ni2+还原为Ni,用于化学镀镍.酸性条件下镀镍溶液中发生如下反应:
1Ni2++1H2PO2-+1(H2O)═1Ni+1H2PO3-+2(H+)
 请完成并配平上列的离子方程式.
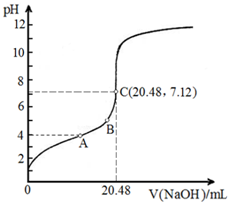
请完成并配平上列的离子方程式.(3)常温下,用0.1000mol•L-1NaOH溶液滴定20.00mL某未知浓度的H3PO2溶液,滴定曲线如图所示:
A点所示溶液中$\frac{c({H}_{2}P{{O}_{2}}^{-})}{c({H}_{3}P{O}_{2})}$=590;
B点所示溶液中所有离子浓度的大小关系是:c(H2PO2-)>c(Na+)>c(H+)>c(OH-);
C点所示溶液中存在:c(H2PO2-)+c(H3PO2)=c(Na+),则H3PO2的物质的量浓度为0.1024mol/L(保留四位有效数字).
分析 (1)由信息①可知H3PO2为一元弱酸,则NaH2PO2为正盐,由信息②可知H3PO2的酸性比醋酸强;
(2)根据氧化还原反应中化合价变化及质量守恒定律判断反应物和生成物,并配平反应方程式、判断还原产物;
(3)离方程式为:H3PO2?H++H2PO2-,A点时pH=4,则c(H+)=10-4mol/L,结合电离常数计算;
B点所示溶液呈酸性,则c(H+)>c(OH-),由溶液的电中性可知c(H2PO2-)>c(Na;
C点所示溶液中存在:c(H2PO2-)+c(H3PO2)=c(Na+),说明n(H3PO2)=n(NaOH),二者恰好完全反应,以此计算该题.
解答 解:(1)A.次磷酸为弱酸,则电离方程式为:H3PO2?H++H2PO2-,故A正确;
B.NaH2PO2属于正盐,故B错误;
C.次磷酸为弱酸,则浓度均为0.1mol•L-1的次磷酸(H3PO2)与盐酸相比前者导电能力弱,故C错误;
D.由信息②可知H3PO2的酸性比醋酸强,则0.1mol•L-1NaH2PO2溶液的pH比0.1mol•L-1CH3COONa溶液的pH小,故D正确.
故答案为:AD;
(2)由氧化还原反应中化合价升降相等进行配平:镍元素的化合价降低了2价,磷元素的化合价升高的2价,根据原子守恒结合电荷守恒可得配平的方程式为:H2O+Ni2++H2PO2-═Ni+H2PO3-+2H+,
故答案为:1;1;1H2O;1;1;2H+;
(3)电离方程式为:H3PO2?H++H2PO2-,A点时pH=4,则c(H+)=10-4mol/L,则$\frac{c({H}_{2}P{{O}_{2}}^{-})}{c({H}_{3}P{O}_{2})}$×(H+)=5.9×10-2,则$\frac{c({H}_{2}P{{O}_{2}}^{-})}{c({H}_{3}P{O}_{2})}$=590,
B点所示溶液呈酸性,则c(H+)>c(OH-),由溶液的电中性可知c(H2PO2-)>c(Na+),则所有离子浓度的大小关系是c(H2PO2-)>c(Na+)>c(H+)>c(OH-),
C点所示溶液中存在:c(H2PO2-)+c(H3PO2)=c(Na+),说明n(H3PO2)=n(NaOH),二者恰好完全反应,此时NaOH的物质的量为0.1000mol•L-1×0.02048L,
则H3PO2的物质的量浓度为$\frac{0.1000mol×0.02048L}{0.02L}$=0.1024 mol/L.
故答案为:590;c(H2PO2-)>c(Na+)>c(H+)>c(OH-);0.1024 mol/L.
点评 本题考查了弱电解质的电离,根据弱电解质的电离平衡特点、酸碱混合溶液酸碱性等知识点来分析解答,灵活运用微粒间关系找出这几个常数之间的关系式是解本题关键,侧重考查学生分析计算能力,题目难度中等.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| A. |  1,3,4-三甲苯 | B. |  2-甲基-2-氯丙烷 | C. |  2-甲基-1-丙醇 | D. |  2-甲基-3-丁炔 |
| A. | 该反应中Cl2发生还原反应 | |
| B. | 根据该反应可判断还原性:S2O32->Cl- | |
| C. | 脱氯反应后,溶液的酸性增强 | |
| D. | SO2与氯气的漂白原理相同,所以也可以用SO2作纺织工业的漂白剂 |
| A. | 酸性:H2CO3>HNO3 | B. | 碱性:NaOH>KOH | ||
| C. | 非金属性:Si>P | D. | 气态氢化物稳定性:H2O>H2S |
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 单质中一定存在共价键 | |
| C. | 共价化合物中一定存在共价键 | |
| D. | 离子化合物中只含有离子键 |
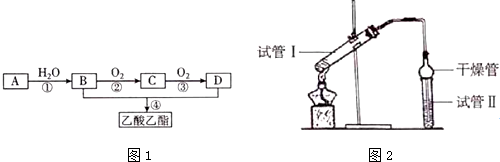
(1)有机物D中官能团的名称为羧基,①、④的反应类型分别为加成反应、酯化反应或取代反应.
(2)反应④的化学方程式为CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
(3)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用图2的装罝制备乙酸乙酯.
①与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是:防倒吸.
②试管Ⅱ中加入的试剂是饱和Na2CO3溶液,其作用是:吸收乙酸和乙醇,降低乙酸乙酯的溶解度.
③为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用该装置进行了以下4 个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管Ⅱ,再测其中有机层的厚度,实验记录如下:
| 实验编号 | 试管I中试剂 | 试管Ⅱ中有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、2mL 18mol•L-1浓硫酸 | 3.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 |
| C | 3mL 乙醇、2mL 乙酸 2mL3mol•L-1H2SO4 | 0.6 |
| D | 3mL乙醇、2mL乙酸、盐酸 | 0.6 |
(4)乙醇在一定条件下可转化为有机物E,E的相对分子质里为74,其分子中碳、氢的质量分数分别为64.9%、13.5%,其余为氧.求E的化学式C原子个数=$\frac{74×64.9%}{12}$≈4、H原子个数=$\frac{74×13.5%}{1}$≈10,则O原子个数=$\frac{74-12×4-1×10}{16}$=1,则C、H、O原子个数之比=4:10:1,则E的化学式为C4H10O(需写出计算过程).
| A. | 每生成0.3molH2,被还原的水分子数目为0.6NA | |
| B. | 当有2.7gAl参加反应时,转移的电子数目为0.3NA | |
| C. | 每生成6.72L的H2,溶液中AlO2-的数目就增加0.2NA | |
| D. | 溶液中每增加0.1mol的AlO2-,Na+的数目就增加0.1NA |
 原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E,F和C位于同一主族,F处于第一个长周期.
原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E,F和C位于同一主族,F处于第一个长周期.
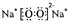 ,该物质含有的化学键的类型是离子键、非极性共价键 .
,该物质含有的化学键的类型是离子键、非极性共价键 . .
.