题目内容
13.Cl2是纺织工业中常用的漂白剂,Na2S2O3可作漂白布匹后的“脱氯剂”.S2O32-和Cl2反应的产物之一为SO42-.下列说法中不正确的是( )| A. | 该反应中Cl2发生还原反应 | |
| B. | 根据该反应可判断还原性:S2O32->Cl- | |
| C. | 脱氯反应后,溶液的酸性增强 | |
| D. | SO2与氯气的漂白原理相同,所以也可以用SO2作纺织工业的漂白剂 |
分析 S2O32-和Cl2反应的产物之一为SO42-,S硫元素平均化合价由+2价升高为+6价,Na2S2O3是还原剂,Cl2→NaCl、HCl,Cl元素化合价由0价降低为-1价,Cl2是氧化剂,根据电子转移相等,所以n(Na2S2O3)×2×(6-2)=n(Cl2)×2,故n(Na2S2O3):n(Cl2)=1:4,结合质量守恒定律配平反应的方程式为:5H2O+S2O32-+4Cl2=2SO42-+8Cl-+10H+,结合氧化还原反应中的概念及规律来解答.
解答 解:S2O32-和Cl2反应的产物之一为SO42-,S元素的化合价升高,则Cl元素的化合价降低,配平后的反应为:5H2O+S2O32-+4Cl2=2SO42-+8Cl-+10H+,
A.因Cl元素的化合价降低,所以氧化剂是Cl2,反应中被还原,故A正确;
B.由还原剂的还原性大于还原产物的还原性可知,还原性:S2O32->Cl-,故B正确;
C.由反应可知生成氢离子,酸性增强,故C正确;
D.SO2与氯气的漂白原理不相同,氯气是利用其氧化性,而二氧化硫是利用化合反应,故D错误;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.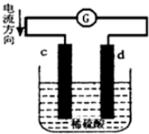 将铜片、锌片插入500mL2mol/L稀硫酸中组成原电池,c、d为两个电极.则下列有关的判断正确的是(溶液体积变化忽略不计)( )
将铜片、锌片插入500mL2mol/L稀硫酸中组成原电池,c、d为两个电极.则下列有关的判断正确的是(溶液体积变化忽略不计)( )
 将铜片、锌片插入500mL2mol/L稀硫酸中组成原电池,c、d为两个电极.则下列有关的判断正确的是(溶液体积变化忽略不计)( )
将铜片、锌片插入500mL2mol/L稀硫酸中组成原电池,c、d为两个电极.则下列有关的判断正确的是(溶液体积变化忽略不计)( )| A. | c为负极,其质量逐渐减小,发生还原反应 | |
| B. | 当有0.2mol电子通过电路,正极表明产生气体2.24L | |
| C. | 电池工作的过程中,溶液中SO42-浓度逐渐减小 | |
| D. | 当负极质量减轻32.5g时,烧杯中溶液中H+的浓度为2mol/L |
4.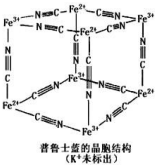 普鲁士蓝晶体结构如图所示(每两个立方体中,一个 K+在其中一个立方体中心,另一个则无 K+),下列说法正确的是( )
普鲁士蓝晶体结构如图所示(每两个立方体中,一个 K+在其中一个立方体中心,另一个则无 K+),下列说法正确的是( )
 普鲁士蓝晶体结构如图所示(每两个立方体中,一个 K+在其中一个立方体中心,另一个则无 K+),下列说法正确的是( )
普鲁士蓝晶体结构如图所示(每两个立方体中,一个 K+在其中一个立方体中心,另一个则无 K+),下列说法正确的是( )| A. | 化学式可以表示为 KFe2(CN)6 | |
| B. | 每一个立方体中平均含有 24 个π键 | |
| C. | 普鲁士蓝不属于配位化合物 | |
| D. | 每个 Fe3+周围与之相邻的 Fe2+离子有 12 个 |
1.100mL6mol/LH2S04与过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
| A. | 硫酸锌溶液 | B. | 氢氧化钠固体 | C. | 碳酸钠固体 | D. | 硫酸铜固体 |
8.下列说法正确的是( )
| A. | 纯碱、汽油去除油污的原理相同 | |
| B. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 | |
| C. | 铁表面镀铜时,铜与电源的正极相连,铁与电源的负极相连 | |
| D. | 分馏、蒸馏、煤的液化都是物理变化,干馏、裂化、裂解都是化学变化 |
5.下列物质互为同分异构体的是( )
| A. | 氧气和臭氧 | B. | 正丁烷和异丁烷 | C. | H2O和D2O | D. | 612C和614C |
2.下列有机物的命名正确的是( )
| A. |  | B. | (CH3)2CHCH3 甲基丙烷 | ||
| C. |  | D. |  |
3.化工厂经常用浓氨水检验输送氯气的管道是否漏气,其反应为3Cl2+8NH3=N2+6NH4Cl,当有3mol NH4Cl产生时,被氧化的氨气是( )
| A. | 4mol | B. | 1mol | C. | 8mol | D. | 2mol |
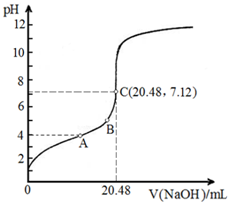 请完成并配平上列的离子方程式.
请完成并配平上列的离子方程式.