题目内容
X、Y、Z、P、Q是5种原子序数依次增大的短周期元素,其中X的原子半径最小,Y、Z位于同一周期,Z、Q位于同一主族,Z原子的最外层电子数是内层电子数的3倍,X、Y能形成YX3得共价化合物,P2+与Z2-具有相同的核外电子排布.请回答下列问题:
(1)写出下列元素符号:X 、Q .
(2)写出Z2-的离子结构示意图: .
(3)Y、Z、Q的最低价氢化物中,热稳定性最好的是: (填化学式,下同),沸点最高的是 .
(4)由Y形成的酸HY3酸性与醋酸相似,写出其电离方程式: ;其钠盐NaY3中各离子浓度相对大小关系: .
(5)P的氯化物溶液,加热蒸干并灼烧后所得固体物质为 .由Y、P构成的化合物溶于水生成2种碱,写出该反应的化学方程式 .
(1)写出下列元素符号:X
(2)写出Z2-的离子结构示意图:
(3)Y、Z、Q的最低价氢化物中,热稳定性最好的是:
(4)由Y形成的酸HY3酸性与醋酸相似,写出其电离方程式:
(5)P的氯化物溶液,加热蒸干并灼烧后所得固体物质为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、P、Q是5种原子序数依次增大的短周期元素,X的原子半径最小,故X为氢;
Y、Z位于同一周期,Z、Q位于同一主族,Z原子的最外层电子数是内层电子数的3倍,Z可能为O或S,结合Z原子序数小于P、Q,且P、Q均为短周期元素,故Z为氧;故Q为硫;
X、Y能形成YX3得共价化合物,结合原子序数小于Z,得知Y为氮;
P2+与Z2-具有相同的核外电子排布,故P为镁,据此解答各小题即可.
Y、Z位于同一周期,Z、Q位于同一主族,Z原子的最外层电子数是内层电子数的3倍,Z可能为O或S,结合Z原子序数小于P、Q,且P、Q均为短周期元素,故Z为氧;故Q为硫;
X、Y能形成YX3得共价化合物,结合原子序数小于Z,得知Y为氮;
P2+与Z2-具有相同的核外电子排布,故P为镁,据此解答各小题即可.
解答:
解:依据分析可知:X为氢、Y为氮、Z为氧、P为镁、Q为硫,
(1)X为氢,元素符号:H,Q为硫,元素符号S,故答案为:H;S;
(2)Z2-为氧离子,即O2-,O2-离子原子核外有10个电子,最外层电子数为8,离子结构示意图为 ,故答案为:
,故答案为: ;
;
(3)N、O、S的最低价氢化物分别为:NH3、H2O、H2S,非金属性越强,其气态氢化物越稳定,故稳定性为:H2O>NH3>H2S,热稳定性最好的是H2O,故答案为:H2O;H2O;
(4)由N形成的酸HN3酸性与醋酸相似,醋酸的电离为:CH3COOH?CH3COO-+H+,故H3N?H2N-+H+;NaN3为强碱弱酸盐,N3?会发生水解显碱性,故NaN3水溶液中离子浓度大小顺序为:
c(Na+)>c(N3?)>c(OH?)>c(H+),故答案为:H3N?H2N-+H+;c(Na+)>c(N3?)>c(OH?)>c(H+);
(5)MgCl2为强酸弱碱盐,在溶液中镁离子水解生成氢氧化镁,即:MgCl2+2H2O?Mg(OH)2+2HCl,由于HCl具有挥发性,加热过程中挥发,故导致MgCl2的水解平衡右移,最终生成氢氧化镁沉淀,氢氧化镁灼烧生成氧化镁和水,故灼烧蒸干最终生成固体产物为MgO,氮化镁水解的产物是氢氧化镁和氨气,即Mg3N2+8H2O═3Mg(OH)2↓+2NH3?H2O,故答案为:MgO;Mg3N2+8H2O═3Mg(OH)2↓+2NH3?H2O.
(1)X为氢,元素符号:H,Q为硫,元素符号S,故答案为:H;S;
(2)Z2-为氧离子,即O2-,O2-离子原子核外有10个电子,最外层电子数为8,离子结构示意图为
 ,故答案为:
,故答案为: ;
;(3)N、O、S的最低价氢化物分别为:NH3、H2O、H2S,非金属性越强,其气态氢化物越稳定,故稳定性为:H2O>NH3>H2S,热稳定性最好的是H2O,故答案为:H2O;H2O;
(4)由N形成的酸HN3酸性与醋酸相似,醋酸的电离为:CH3COOH?CH3COO-+H+,故H3N?H2N-+H+;NaN3为强碱弱酸盐,N3?会发生水解显碱性,故NaN3水溶液中离子浓度大小顺序为:
c(Na+)>c(N3?)>c(OH?)>c(H+),故答案为:H3N?H2N-+H+;c(Na+)>c(N3?)>c(OH?)>c(H+);
(5)MgCl2为强酸弱碱盐,在溶液中镁离子水解生成氢氧化镁,即:MgCl2+2H2O?Mg(OH)2+2HCl,由于HCl具有挥发性,加热过程中挥发,故导致MgCl2的水解平衡右移,最终生成氢氧化镁沉淀,氢氧化镁灼烧生成氧化镁和水,故灼烧蒸干最终生成固体产物为MgO,氮化镁水解的产物是氢氧化镁和氨气,即Mg3N2+8H2O═3Mg(OH)2↓+2NH3?H2O,故答案为:MgO;Mg3N2+8H2O═3Mg(OH)2↓+2NH3?H2O.
点评:本题主要考查的是元素的推断以及元素化合物的知识,涉及电离方程式数的书写、离子结构示意图等,属于常考题.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
某温度下,在一容积固定的容器中,反应aA(g)+bB(g)═hH(g)达到平衡后,A、B、H的物质的量分别为a mol、b mol和h mol.已知a+b=2h,若保持温度不变,将三者的物质的量增大一倍,则下列判断正确的是( )
| A、平衡不移动 |
| B、混合气体的密度不变 |
| C、B的体积分数增大 |
| D、a mol/L<c(A)<2a mol/L |
下列有关描述中,与事实相符的是( )
| A、Al(OH)3、CaCO3都难溶,但溶解的部分都能完全电离 |
| B、复盐是纯净物,而混盐(如CaOCl2)是混合物 |
| C、弱电解质溶液中有溶质分子,但强电解质溶液中难以存在溶质分子 |
| D、电解质溶液能够导电,是因为通电使电解质电离产生了自由移动的离子 |
下列各组离子在溶液中既可以大量共存,且加入氢氧化钠溶液后也不产生沉淀的是( )
| A、Na+、Ba2+、Cl-、SO42- |
| B、K+、Na+、NO3-、OH- |
| C、H+、NH4+、Fe3+、SO42- |
| D、H+、Cl-、CH3COO-、NO3- |
在无色溶液中能大量共存的离子组是( )
| A、Ca2+、Cl-、CO32- |
| B、K+、Na+、SO42- |
| C、HCO3-、Na+、OH- |
| D、K+、Fe3+、SCN- |
体积相同的盐酸和醋酸两溶液中n(Cl-)=n(CH3COO-)=0.01mol,下列正确的是( )
| A、两种溶液的pH不相同 |
| B、它们与NaOH完全中和时,醋酸溶液所消耗的NaOH多 |
| C、分别用水稀释相同倍数时,n(Cl-)=n(CH3COO-) |
| D、它们分别与足量CaCO3反应时,放出的CO2一样多 |
在容积不变的密闭容器中存在如下反应:2A(g)+B(g)═3C(g)+D(s)△H<0,某研究小组研究了在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是( )


| A、图Ⅰ表示增加反应物浓度对该平衡的影响 |
| B、图Ⅱ表示减小压强对该平衡的影响 |
| C、图Ⅲ表示温度对该平衡的影响,温度:乙>甲 |
| D、图Ⅳ表示催化剂对该平衡的影响,催化效率:甲>乙 |

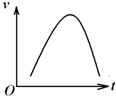 氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl-的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快.
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl-的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快.