题目内容
14.氧化还原反应中实际上包含氧化和还原两个过程.下面有两个变化的反应式:①NO3-+4H++3e-═NO↑+2H2O,
②2H2O2═2H2O+O2↑.
(1)①是还原过程,写出H2O2的电子式
 .
.(2)已知H2O2和KI可发生如下反应:
③H2O2+KI═KIO+H2O,
④2KIO═2KI+O2↑.
写出反应③的离子方程式H2O2+I-═IO-+H2O.综合③④两个反应,KI的作用是催化作用,总反应方程式可表示为2H2O2═2H2O+O2↑.
分析 (1)得电子被还原,双氧水是共价化合物,氧原子和氧原子间存在非极性共价键,氢原子和氧原子间存在极性共价键;
(2)H2O2与KI作用时,KI参加了化学反应,但反应前后其性质和质量均无改变.
解答 解:(1)该反应中硝酸根离子得电子发生还原反应,所以是还原过程,双氧水的电子式为 ,
,
故答案为:还原; ;
;
(2)双氧水和水是弱电解质,碘化钾、次碘酸钾都是强电解质,所以其离子方程式为H2O2+I-═IO-+H2O,H2O2与KI作用时,KI参加了化学反应,但反应前后其性质和质量均无改变,因此它实际是催化剂,对H2O2的分解起催化作用,将方程式③×2+④得2H2O2═2H2O+O2↑,
故答案为:H2O2+I-═IO-+H2O;催化作用;2H2O2═2H2O+O2↑.
点评 本题考查了氧化还原反应,明确元素化合价变化是解本题关键,离子方程式的书写是学习难点,注意KI作用的判断方法,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列每组的物理量,不能求物质的量的是( )
① | ② | ③ | ④ | ⑤ |
物质的粒子数 | 标准状况下气体摩尔体积 | 固体体积 | 溶质的质量分数 | 非标准状况物质的质量 |
阿伏加德罗常数 | 标准状况气体体积 | 固体密度 | 溶液的体积 | 物质的摩尔质量 |
A.①③ B.③④ C.②③④ D.③④⑤
2.下列名词与氮元素无关的是( )
| A. | 光化学烟雾 | B. | 水体富营养化 | C. | 酸雨 | D. | 地方性甲状腺肿 |
19. 常温下,向20mL 0.2mol/L二元酸H2A溶液中滴加0.2mol/LNaOH溶液,有关微粒物质的量变化如图.下列叙述正确的是( )
常温下,向20mL 0.2mol/L二元酸H2A溶液中滴加0.2mol/LNaOH溶液,有关微粒物质的量变化如图.下列叙述正确的是( )
 常温下,向20mL 0.2mol/L二元酸H2A溶液中滴加0.2mol/LNaOH溶液,有关微粒物质的量变化如图.下列叙述正确的是( )
常温下,向20mL 0.2mol/L二元酸H2A溶液中滴加0.2mol/LNaOH溶液,有关微粒物质的量变化如图.下列叙述正确的是( )| A. | 从图象中可知H2A为强酸 | |
| B. | 当V(NaOH)=20 mL时,溶液中各离子浓度的大小顺序为c(Na+)>c(HA-)>c(H+)>c( A2-)>c(OH-) | |
| C. | 当V(NaOH)=20 mL时混合溶液的pH值大于7 | |
| D. | 当V(NaOH)=40 mL时,升高温度,c(Na+)/c(A2-)减小 |
3.常温下,lLpH=2.5的HNO3溶液与10L稀NaOH溶液混合后,测得pH=7.则原 NaOH溶液的pH为( )
| A. | 9.0 | B. | 9.5 | C. | 10.5 | D. | 11.0 |
4. 乙苯(
乙苯(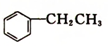 )在有机合成中占有重要的地位,有着广泛的用途.
)在有机合成中占有重要的地位,有着广泛的用途.
已知:①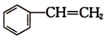 (g)+HCl(g)?
(g)+HCl(g)? (g)△H1=-54kJ•mol-1
(g)△H1=-54kJ•mol-1
②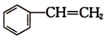 (g)+H2(g)?
(g)+H2(g)? (g)△H2=-121kJ•mol-1
(g)△H2=-121kJ•mol-1
③H2(g)+Cl2(g)═2HCl(g),△H3=-185kJ•mol-1
④相关化学键的键能数据如表所示:
请回答:
(1)根据化学反应原理,缩小容器容积对反应②的影响为缩小容器容积反应速率加快,平衡正向进行,反应物转化率增大;
(2)根据反应①和表中数据计算,x=615;
(3) (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(g)△H4
(g)+HCl(g)△H4
①△H4=-118KJ/mol;
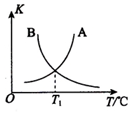
②该反应正、逆反应平衡常数与温度的关系如图所示,其中表示正反应平衡常数K正的曲线为B(填“A”或“B”),理由为反应正反应为放热反应,升温平衡逆向进行平衡常数减小;
③T1℃时,该反应的平衡常数K=1,该温度下,起始向容积为10L的容积可变的密闭容器中充入1mol (g)、2mol Cl2(g)、1mol
(g)、2mol Cl2(g)、1mol  (g)、2mol HCl(g),则开始时,v正=(填“>”、“<”或“=”)v逆.
(g)、2mol HCl(g),则开始时,v正=(填“>”、“<”或“=”)v逆.
 乙苯(
乙苯(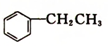 )在有机合成中占有重要的地位,有着广泛的用途.
)在有机合成中占有重要的地位,有着广泛的用途.已知:①
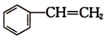 (g)+HCl(g)?
(g)+HCl(g)? (g)△H1=-54kJ•mol-1
(g)△H1=-54kJ•mol-1②
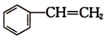 (g)+H2(g)?
(g)+H2(g)? (g)△H2=-121kJ•mol-1
(g)△H2=-121kJ•mol-1③H2(g)+Cl2(g)═2HCl(g),△H3=-185kJ•mol-1
④相关化学键的键能数据如表所示:
| 化学键 | C-H | C-C | C=C | C-Cl | H-Cl |
| 键能/(kJ•mol-1) | 412 | 348 | X | 341 | 432 |
(1)根据化学反应原理,缩小容器容积对反应②的影响为缩小容器容积反应速率加快,平衡正向进行,反应物转化率增大;
(2)根据反应①和表中数据计算,x=615;
(3)
 (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(g)△H4
(g)+HCl(g)△H4①△H4=-118KJ/mol;
②该反应正、逆反应平衡常数与温度的关系如图所示,其中表示正反应平衡常数K正的曲线为B(填“A”或“B”),理由为反应正反应为放热反应,升温平衡逆向进行平衡常数减小;
③T1℃时,该反应的平衡常数K=1,该温度下,起始向容积为10L的容积可变的密闭容器中充入1mol
 (g)、2mol Cl2(g)、1mol
(g)、2mol Cl2(g)、1mol  (g)、2mol HCl(g),则开始时,v正=(填“>”、“<”或“=”)v逆.
(g)、2mol HCl(g),则开始时,v正=(填“>”、“<”或“=”)v逆. 