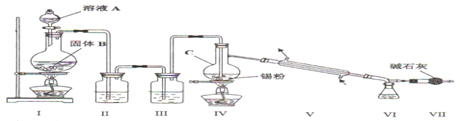
题目内容
6.某食用白醋是由醋酸与纯水配制而成,用0.1000mol/L NaOH溶液准确测定其中醋酸的物质的量浓度.以下为某同学列出的实验步骤(未排序),请回答下列问题.A.分别向碱式滴定管、酸式滴定管注入NaOH标准溶液和待测醋酸至0刻度以上2~3cm
B.调节滴定管液面至0或0刻度以下,记下读数
C.用NaOH标准溶液滴定至终点,记下滴定管液面的刻度
D.用标准溶液清洗碱式滴定管2~3次;待测醋酸清洗酸式滴定管2~3次
E.用待测醋酸清洗锥形瓶2~3次
F.排气泡使滴定管尖嘴充满溶液,把滴定管固定好
G.滴定管检漏,用水清洗所有仪器,备用
H.通过酸式滴定管向锥形瓶注入20.00mL待测醋酸,并加入2-3滴指示剂
(1)用离子方程式表示该实验的原理CH3COOH+OH-=CH3COO-+H2O.
(2)从上述实验步骤中选出正确的并按操作先后排序.你的实验顺序为:(用字母表示)G→D→A→F→B→H→C.
(3)实验室常用的酸碱指示剂有甲基橙、石蕊和酚酞,你选择的指示剂是酚酞,理由是两者恰好完全中和生成醋酸钠,其水溶液呈碱性,必需选择在碱性范围变色且颜色容易判断的酚酞作指示剂判断滴定终点;滴定终点的现象是当滴加最后一滴氢氧化钠溶液时,溶液变为浅红色且30s不褪色.
(4)某同学实验后得到的数据如下:
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 | 5 |
| V(NaOH)/mL(初读数) | 0.00 | 0.20 | 0.00 | 0.10 | 0.05 |
| V(NaOH)/mL(终读数) | 15.75 | 15.20 | 14.98 | 15.12 | 15.05 |
(5)分析下列操作对测定结果的影响,用“偏低”、“偏高”或“不影响”填空.
①滴定前碱式滴定管充满溶液,滴定后尖嘴处有气泡偏低;
②读取标准溶液体积时,滴定前平视,滴定后仰视偏高.
分析 (1)氢氧化钠与醋酸生成醋酸钠和水,醋酸是弱酸,书写离子方程式时不能拆开;
(2)滴定时操作步骤为:滴定管查漏→水洗→润洗→注液、调节液面→排气泡、记录刻度→注入待测液→滴定至终点读数.
(3)醋酸与氢氧化钠溶液完全中和后生成醋酸钠溶液,呈碱性,所以应选择在碱性范围内变色的指示剂(酚酞),终点的现象是当滴加最后一滴氢氧化钠溶液时,溶液变为浅红色且30s不褪色.
(4)先分析数据的有效性,然后求出平均值,然后根据C(NaOH)V(NaOH)=C(CH3COOH)V(CH3COOH)得醋酸物质的量浓度;
(5)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:(1)氢氧化钠与醋酸生成醋酸钠和水,用离子方程式表示该实验的原理为:CH3COOH+OH-=CH3COO-+H2O,故答案为:CH3COOH+OH-=CH3COO-+H2O;
(2)滴定时操作步骤为:滴定管查漏→水洗→润洗→注液、调节液面→排气泡、记录刻度→注入待测液→滴定至终点读数,
故答案为:G→D→A→F→B→H→C;
(3)醋酸与氢氧化钠溶液完全中和后生成醋酸钠溶液,呈碱性,所以应选择在碱性范围内变色的指示剂(酚酞),终点的现象是当滴加最后一滴氢氧化钠溶液时,溶液变为浅红色且30s不褪色.
故答案为:酚酞;两者恰好完全中和生成醋酸钠,其水溶液呈碱性,必需选择在碱性范围变色且颜色容易判断的酚酞作指示剂判断滴定终点;当滴加最后一滴氢氧化钠溶液时,溶液变为浅红色且30s不褪色;
(4)五次实验消耗氢氧化钠溶液体积分别为15.75mL、15.00mL、14.98mL、15.02mL、15.00mL,其中15.75mL误差太大,应舍弃,所以氢氧化钠溶液体积平均为15.00mL,氢氧化钠溶液浓度为0.1mol/L,醋酸体积为20.00mL,由C(NaOH)V(NaOH)=C(CH3COOH)V(CH3COOH)得醋酸物质的量浓度为0.07500mol/L,
故答案为:0.07500;
(5)①滴定前碱式滴定管充满溶液,滴定后尖嘴处有气泡,则氢氧化钠溶液体积偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知醋酸浓度偏小,
故答案为:偏低;
②读取标准溶液体积时,滴定前平视、滴定后仰视,则氢氧化钠溶液体积偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知醋酸浓度偏高,
故答案为:偏高.
点评 本题主要考查了酸碱中和滴定的操作步骤、化学计算、指示剂选择,题目难度中等,在分析误差的关键是分析滴定管中氢氧化钠溶液的体积,若氢氧化钠溶液体积偏大,则所测醋酸浓度偏大,侧重于考查学生的分析能力和计算能力.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案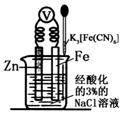
| A. | 该装置为电解池 | |
| B. | 本实验牺牲了金属Fe来保护金属Zn | |
| C. | 若加入K3[Fe(CN)6]溶液后,Fe电极附近不会产生特征蓝色的沉淀 | |
| D. | 远洋货轮上镶嵌的金属Zn长时间没有什么变化,不需要更换 |
(1)将已称量好的8.8g烧碱样品配制成500mL待测液,配制过程使用的主要仪器除 500mL容量瓶、量筒、烧杯、胶头滴管外,还有一种必须使用的仪器是玻璃棒;
(2)用碱式滴定管量取10.00mL待测液于锥形瓶中,滴入几滴酚酞;
(3)用0.20mol•Lˉ1的标准盐酸滴定待测液,判断滴定终点的现象是:当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不褪色;
(4)经过分析发现,本次实验的测定结果比烧碱的实际纯度偏高,造成误差的可能原因是BCDF;
A.滴定前平视,滴定后俯视
B.未用标准液润洗滴定管
C.用待测液润洗锥形瓶
D.不小心将标准液滴在锥形瓶外面
E.滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁
F.滴定前尖嘴有气泡,滴定后消失
(5)根据下列数据计算,烧碱的纯度为91%(保留整数).
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.60 | 20.50 |
| 第二次 | 10.00 | 3.00 | 23.10 |
| A. | Na+ | B. | Mg2+ | C. | HCl | D. | HF |
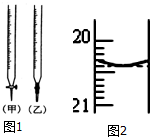 某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题:
某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题: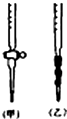 阅读下列实验内容,根据题目要求回答问题:
阅读下列实验内容,根据题目要求回答问题: