题目内容
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
(1)Z原子的原子结构示意图为 ;
(2)化合物甲由元素X与Y组成,1mol甲含18mol电子,请写出甲的电子式: ;
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,其离子方程式为 .
(4)已知离子化合物乙由X、Y、Z、W四种元素组成,乙既能与盐酸反应,又能与氯水反应,1mol 乙能与过量NaOH浓溶液反应,最多可生成22.4L气体(标准状况).写出加热条件下乙与过量NaOH溶液反应的离子方程式 .
(5)用亚硝酸氧化化合物甲,可生成氮的另一种氢化物,该氢化物的相对分子质量为43,其中氮原子的质量分数为97.7%,该氢化物的分子式为 .该氢化物受撞击时完全分解为氮气和氢气,则2.15g该氢化物受撞击后产生的气体在标况下的体积为 L.
(1)Z原子的原子结构示意图为
(2)化合物甲由元素X与Y组成,1mol甲含18mol电子,请写出甲的电子式:
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,其离子方程式为
(4)已知离子化合物乙由X、Y、Z、W四种元素组成,乙既能与盐酸反应,又能与氯水反应,1mol 乙能与过量NaOH浓溶液反应,最多可生成22.4L气体(标准状况).写出加热条件下乙与过量NaOH溶液反应的离子方程式
(5)用亚硝酸氧化化合物甲,可生成氮的另一种氢化物,该氢化物的相对分子质量为43,其中氮原子的质量分数为97.7%,该氢化物的分子式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:原子序数由小到大排列的四种短周期元素X、Y、Z、W,在周期表中X是原子半径最小的元素,则X为H元素;Z、W位于同主族,设Z的原子序数为x,则W的原子序数为x+8,Y、Z左右相邻,Y的原子序数为x-1,由四种元素的原子序数之和为32,则1+(x-1)+x+(x+8)=32,解得x=8,即Y为N元素,Z为O元素,W为S元素,据此答题.
解答:
解:原子序数由小到大排列的四种短周期元素X、Y、Z、W,在周期表中X是原子半径最小的元素,则X为H元素;Z、W位于同主族,设Z的原子序数为x,则W的原子序数为x+8,Y、Z左右相邻,Y的原子序数为x-1,由四种元素的原子序数之和为32,则1+(x-1)+x+(x+8)=32,解得x=8,即Y为N元素,Z为O元素,W为S元素.
(1)Z为O元素,原子结构示意图为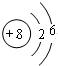 ,故答案为:
,故答案为: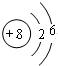 ;
;
(2)化合物甲由元素X与Y组成,1mol甲含18mol电子,则甲的化学式为N2H4,它的电子式为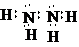 ,故答案为:
,故答案为: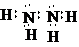 ;
;
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,故该酸是HNO3,稀硝酸与铜离子方程式为 3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(4)离子化合物乙由X、Y、Z、W四种元素组成,乙既能与盐酸反应,又能与氯水反应,1mol 乙能与过量NaOH浓溶液反应,最多可生成22.4L气体(标准状况),乙为NH4HSO3,加热条件下NH4HSO3与过量NaOH溶液反应生成氨气、水、亚硫酸钠,反应的离子方程式为NH4++HSO3-+OH-
NH3↑+SO32-+2H2O.
故答案为:NH4++HSO3-+OH-
NH3↑+SO32-+2H2O;
(5)氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,则氢原子的质量分数为0.023,则n(N):n(H)=
:
=3:1,所以最简式为HN3,设化学式为(HN3)n,有(1+14×3)n=43,n=1,所以分子式为HN3,
2.15g该氢化物的物质的量为n=
=0.05mol,根据反应2HN3═H2+3N2,共产生气体的物质的量为0.05mol×2=0.1mol,体积为0.1mol×22.4L/mol=2.24L,
故答案为:HN3;2.24.
(1)Z为O元素,原子结构示意图为
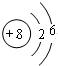 ,故答案为:
,故答案为: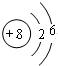 ;
;(2)化合物甲由元素X与Y组成,1mol甲含18mol电子,则甲的化学式为N2H4,它的电子式为
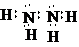 ,故答案为:
,故答案为: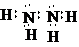 ;
;(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,故该酸是HNO3,稀硝酸与铜离子方程式为 3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(4)离子化合物乙由X、Y、Z、W四种元素组成,乙既能与盐酸反应,又能与氯水反应,1mol 乙能与过量NaOH浓溶液反应,最多可生成22.4L气体(标准状况),乙为NH4HSO3,加热条件下NH4HSO3与过量NaOH溶液反应生成氨气、水、亚硫酸钠,反应的离子方程式为NH4++HSO3-+OH-
| ||
故答案为:NH4++HSO3-+OH-
| ||
(5)氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,则氢原子的质量分数为0.023,则n(N):n(H)=
| 0.977 |
| 14 |
| 0.023 |
| 1 |
2.15g该氢化物的物质的量为n=
| 2.15g |
| 43g/mol |
故答案为:HN3;2.24.
点评:本题主要考查了原子结构示意图、电子式、离子方程式、化学计算等知识点,中等难度,计算是本题难点,元素推断是解题关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用NA代表阿伏加德罗常数,下列说法正确的是( )
| A、25℃和101KPa的条件下,4.9LCH4完全燃烧生成的H2O的分子数为0.4NA |
| B、1molNH3中含有3NA对电子对 |
| C、Na2O2与H2O反应生成标准状况下11.2 L O2时,转移的电子数为2NA |
| D、标准状况下,2.24L HF中所含电子数为NA |
下列各图所表示的反应属于放出热量的是( )
A、 |
B、 |
C、 |
D、 |
下列化学用语和描述均正确的是( )
A、结构示意图为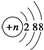 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | ||
B、球棍模型为: 的分子可发生加成反应 的分子可发生加成反应 | ||
C、符号为
| ||
D、电子式分别为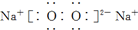 和 和 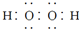 的两种化合物均为常见的氧化剂 的两种化合物均为常见的氧化剂 |