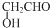题目内容
20. 我国成功研制出新型“海水电池”.电池反应为4Al+3O2+6H2O═4Al(OH)3.下列关于该电池的说法不正确的是( )
我国成功研制出新型“海水电池”.电池反应为4Al+3O2+6H2O═4Al(OH)3.下列关于该电池的说法不正确的是( )| A. | 铝片作负极 | |
| B. | 海水作为电解质溶液 | |
| C. | 电池工作时O2得到电子 | |
| D. | 电池工作时实现了电能向化学能的转化 |
分析 根据电池总反应可知,电池工作时,负极为Al,发生氧化反应,电极反应式为Al-3e-+3OH-=Al(OH)3,正极上通入空气,发生还原反应,正极反应式为O2+2H2O+4e-=4OH-,结合原电池的工作原理解答该题.
解答 解:A.由方程式可知Al被氧化,应为原电池的负极,故A正确;
B.海水中含有氯化钠等电解质,可导电,为原电池反应的电解质溶液,故B正确;
C.空气中氧气在正极发生还原反应,故C正确;
D.原电池为化学能转化为电能的装置,故D错误.
故选D.
点评 本题考查化学电源知识,为高频考点,侧重于双基的考查,题目难度中等,注意原电池两极上的变化以及原电池原理.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
10.硅酸铜钡是当今用最新科学技术才能合成的一种物质.然而现在发现,我国秦朝兵马俑用的一种颜料竟是硅酸铜钡.下列关于硅酸铜钡的学说错误的是( )
| A. | 易溶于水 | B. | 难溶于水 | C. | 属于硅酸盐 | D. | 有颜色 |
11.短周期主族元素A、B、C、D的原子序数依次增大.已知A、C的原子序数之差为8,A、B、C三种元素原子的最外层电子数之和为15,B元素原子的最外层电子数等于A元素原子的最外层电子数的一半,下列叙述正确的是( )
| A. | 简单离子的半径:B>C>D>A | |
| B. | 氢化物的稳定性:C>D | |
| C. | A与C形成的化合物溶于水所得溶液显碱性 | |
| D. | B与D形成的化合物溶于水所得溶液显酸性 |
8.下列物质互为同分异构体的是( )
| A. | ${\;}_{1}^{1}$H2O和${\;}_{1}^{2}$H2O | B. | 乙烯和丙烯(CH2=CHCH3) | ||
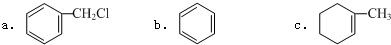
| C. | 石墨和C60 | D. | 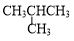 和CH3CH2CH2CH3 和CH3CH2CH2CH3 |
15.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 44g CO2含有的原子数目为NA | |
| B. | 常温常压下,22.4L CCl4含有的分子数目为NA | |
| C. | 32gCu与足量浓硝酸充分反应,转移电子数目为NA | |
| D. | 1mol•L-1CuSO4溶液中含有的硫酸根离子数目为NA |
10.有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液的实验如下:
由此判断,下列说法正确的是( )
| 实验步骤 | 实验现象 |
| (1)取少量该溶液,加几滴甲基橙 | 溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和浓硫酸,加热 | 有无色气体产生,气体遇空气可以变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| (4)取(3)中的上层清液,加AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于稀硝酸 |
| (5)取少量该溶液,加入NaOH溶液 | 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
| A. | 根据实验(1)可以确定溶液中不含有HCO3-和I-,因为这二个离子相对应的酸为弱酸 | |
| B. | 溶液中一定存在的离子是NO3-、SO42-、Cl-、Mg2+、Al3+;溶液中肯定不存在的离子是:Fe2+、HCO3-、I-、Ba2+ | |
| C. | 为进一步确定其它离子,应该补充焰色反应的实验来检验K+就可以 | |
| D. | 通过实验(1)和(2)就可以确定溶液中一定含有NO3-,一定不含有Fe2+、I-、HCO3-,所以实验步骤(4)的设计是错误的 |