题目内容
下列溶液中NO3-的物质的量浓度最大的是( )
| A、500mL 1mol/L的KNO3溶液 |
| B、500mL 1mol/L的Ba(NO3)2溶液 |
| C、1000mL 0.5mol/L的Mg(NO3)2溶液 |
| D、1L 0.5mol/L的Fe(NO3)3溶液 |
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:电解质产生的离子浓度等于电解质的浓度与化学式中该离子个数的乘积,与溶液的体积无关,以此解答该题.
解答:
解:A.1mol/L的KNO3溶液中NO3- 物质的量浓度=1mol/L;
B.1mol/L的Ba(NO3)2溶液中NO3- 物质的量浓度=1mol/L×2=2mol/L;
C.0.5mol/L的Mg(NO3)2溶液中NO3- 物质的量浓度=0.5mol/L×2=1mol/L;
D.0.5mol/L的Fe(NO3)3溶液中NO3- 物质的量浓度=0.5mol/L×3=1.5mol/L,
NO3-的物质的量浓度最大的是B.
故选B.
B.1mol/L的Ba(NO3)2溶液中NO3- 物质的量浓度=1mol/L×2=2mol/L;
C.0.5mol/L的Mg(NO3)2溶液中NO3- 物质的量浓度=0.5mol/L×2=1mol/L;
D.0.5mol/L的Fe(NO3)3溶液中NO3- 物质的量浓度=0.5mol/L×3=1.5mol/L,
NO3-的物质的量浓度最大的是B.
故选B.
点评:本题考查电解质浓度与电解质产生离子浓度关系,注意理解电解质产生的离子浓度等于电解质的浓度与化学式中该离子个数的乘积,与溶液的体积无关,难度不大.

练习册系列答案
相关题目
图Ⅰ、Ⅱ分别是甲、乙两组同学将反应AsO43-+2I-+2H+═AsO33-+I2+H2O设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40% NaOH溶液.下列叙述中正确的是( )
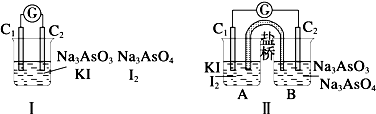

| A、甲组操作时,电流计(G)指针发生偏转 |
| B、乙组操作时,C1上发生的电极反应为 I2+2e-═2I- |
| C、甲组操作时,溶液颜色变浅 |
| D、乙组操作时,C2做正极 |
pH相同的CH3COOH和HCl,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后溶液pH仍相同,则m、n的关系为( )
| A、m=n | B、m>n |
| C、m<n | D、无法确定 |
下列说法不正确的是( )
| A、制取蒸馏水时,为了防止瓶内产生暴沸现象,应向烧瓶内加入几片碎瓷片 |
| B、用胶头滴管向试管中滴加液体时,胶头滴管紧贴试管内壁 |
| C、蒸馏时,冷却水应从冷凝器下端进入 |
| D、不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液 |
