题目内容
一定量的混合气体在密闭容器中发生反应 m A (g)+n B (g)?p C (g)达到平衡后,温度不变,将气体体积缩小到原来的
,达到平衡时,C的浓度为原来的2.5倍,则下列说法不正确的是( )
| 1 |
| 2 |
| A、m+n>p |
| B、C的体积分数增加 |
| C、平衡向正反应方向移动 |
| D、A 的转化率降低 |
考点:化学平衡的计算
专题:
分析:平衡后将气体体积缩小到原来的
,压强增大,如果平衡不移动,则达到平衡时C的浓度为原来的2倍,但此时C的浓度为原来的2.5倍,说明增大压强平衡向正反应方向移动,正反应是气体体积减小的反应,然后根据平衡移动原理、体积分数的表达式等对各选项分析.
| 1 |
| 2 |
解答:
解:平衡后将气体体积缩小到原来的
,压强增大,如果平衡不移动,则达到平衡时C的浓度为原来的2倍,而此时C的浓度为原来的2.5倍,说明增大压强平衡向正反应反应方向移动,正反应方向是气体体积减小的反应,
A、增大压强平衡向正反应方向移动,增大压强平衡向体积减小的方向移动,则有:m+n>p,故A正确;
B、由上述分析可知,增大压强平衡向正反应方向移动,C的体积分数增大,故B正确;
C、根据分析可知,增大压强平衡向正反应方向移动,故C正确;
D、增大压强平衡向正反应方向移动,则反应物A的转化率增大,故D错误;
故选D.
| 1 |
| 2 |
A、增大压强平衡向正反应方向移动,增大压强平衡向体积减小的方向移动,则有:m+n>p,故A正确;
B、由上述分析可知,增大压强平衡向正反应方向移动,C的体积分数增大,故B正确;
C、根据分析可知,增大压强平衡向正反应方向移动,故C正确;
D、增大压强平衡向正反应方向移动,则反应物A的转化率增大,故D错误;
故选D.
点评:本题考查化学平衡的影响因素,题目难度中等,明确”将气体体积缩小到原来的
,平衡不移动,则达到平衡时C的浓度为原来的2倍,而实际上C的浓度为原先的2.5倍”的含义为解答关键,注意掌握化学平衡及其影响因素.
| 1 |
| 2 |

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
在一定条件下,在容积为2L的密闭容器中,将2mol 气体M和3mol N气体混合,发生如下反应:2M(g)+3N(g)?x Q(g)+3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4mol/L,下列有关叙述正确的是( )
| A、x值为2 |
| B、混合气体的密度增大 |
| C、平衡时N的浓度为0.6 mol/L |
| D、N的转化率为80% |
头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应极小,因而被广泛适用于敏感细菌所致的尿路感染、皮肤软组织感染以及急性扁桃体炎、急性咽炎、中耳炎和肺部感染等的治疗.已知肽键可以在碱性条件下水解,下列对头孢羟氨苄的说法中正确的是( )
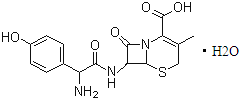

| A、头孢羟氨苄的化学式为C16H16N3O5S?H2O |
| B、1mol头孢羟氨苄与NaOH溶液和浓溴水反应时,分别需要消耗NaOH 4mol和Br2 3mol |
| C、在催化剂存在的条件下,1mol头孢羟氨苄消耗7molH2 |
| D、头孢羟氨苄在空气中能稳定存在 |
下列有关物质的表达式不正确的是( )
| A、乙烯的最简式:C2H4 |
| B、CS2分子的结构式:S═C═S |
| C、醛基的结构简式:-CHO |
D、(羟基)的电子式为: |

 用如图所示的收集装置收集氨气时,由于气流略强使得在试管底部形成气旋,导致氨气与空气混合而不能收集到纯氨气.现在有一小团棉花,请问将棉花放在试管那个位置可以阻止气旋?请说明理由.
用如图所示的收集装置收集氨气时,由于气流略强使得在试管底部形成气旋,导致氨气与空气混合而不能收集到纯氨气.现在有一小团棉花,请问将棉花放在试管那个位置可以阻止气旋?请说明理由.