题目内容
在一定条件下,在容积为2L的密闭容器中,将2mol 气体M和3mol N气体混合,发生如下反应:2M(g)+3N(g)?x Q(g)+3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4mol/L,下列有关叙述正确的是( )
| A、x值为2 |
| B、混合气体的密度增大 |
| C、平衡时N的浓度为0.6 mol/L |
| D、N的转化率为80% |
考点:化学平衡的计算
专题:
分析:A.根据n=cV计算生成Q的物质的量,结合R的物质的量,利用物质的量之比等于化学计量数之比计算x的值;
B.容器的容积不变,混合气体的质量不变,根据ρ=
判断;
C.根据生成的R的物质的量,利用物质的量之比等于化学计量数之比计算参加反应的N的物质的量,N的平衡浓度=
;
D.根据C可知参加反应的N的物质的量,然后根据转化率的表达式计算出N的转化率.
B.容器的容积不变,混合气体的质量不变,根据ρ=
| m |
| V |
C.根据生成的R的物质的量,利用物质的量之比等于化学计量数之比计算参加反应的N的物质的量,N的平衡浓度=
| n |
| V |
D.根据C可知参加反应的N的物质的量,然后根据转化率的表达式计算出N的转化率.
解答:
解:A.平衡时生成的Q的物质的量为:0.4mol/L×2L=0.8mol,生成R为2.4mol,物质的量之比等于化学计量数之比,故0.8mol:2.4mol=x:3,解得x=1,故A错误;
B.反应体系中各组分都是气体,混合气体的质量不变,容器的容积恒定,根据ρ=
可知混合气体的密度不变,故B错误;
C.反应达到平衡时,生成2.4molR,由方程式2M(g)+3N(g)?x Q(g)+3R(g)可知,参加反应的N的物质的量为2.4mol,故平衡时N的物质的量为3mol-2.4mol=0.6mol,N的平衡浓度为:c(N)=
=0.3mol/L,故C错误;
D.参加反应的N的物质的量为2.4mol,则N的转化率为:
×100%=80%,故D正确;
故选D.
B.反应体系中各组分都是气体,混合气体的质量不变,容器的容积恒定,根据ρ=
| m |
| V |
C.反应达到平衡时,生成2.4molR,由方程式2M(g)+3N(g)?x Q(g)+3R(g)可知,参加反应的N的物质的量为2.4mol,故平衡时N的物质的量为3mol-2.4mol=0.6mol,N的平衡浓度为:c(N)=
| 0.6mol |
| 2L |
D.参加反应的N的物质的量为2.4mol,则N的转化率为:
| 2.4mol |
| 3mol |
故选D.
点评:本题考查了化学平衡的计算,题目难度中等,注意掌握化学反应速率、物质的量浓度、转化率等概念及计算方法,明确有关化学平衡的计算方法,试题侧重考查学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
一定量的混合气体在密闭容器中发生反应 m A (g)+n B (g)?p C (g)达到平衡后,温度不变,将气体体积缩小到原来的
,达到平衡时,C的浓度为原来的2.5倍,则下列说法不正确的是( )
| 1 |
| 2 |
| A、m+n>p |
| B、C的体积分数增加 |
| C、平衡向正反应方向移动 |
| D、A 的转化率降低 |
下列分离和提纯的实验中,所选用的方法或仪器不正确的是( )
| 序号 | A | B | C | D |
| 实验目的 | 分离食盐水与泥沙 | 分离水和CCl4 | 制取蒸馏水 | 从浓食盐水中得到氯化钠晶体 |
| 分离方法 | 过滤 | 萃取 | 蒸馏 | 蒸发 |
| 选用仪器 |  |  |  |  |
| A、A | B、B | C、C | D、D |
某位同学配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )
| A、所用NaOH已经潮解 |
| B、向容量瓶中加水未到刻度线 |
| C、有少量NaOH溶液残留在烧杯里 |
| D、用带游码的托盘天平称2.4gNaOH时误用了“左码右物”方法 |
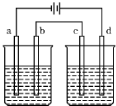 按图电解实验装置(都是惰性电极),若通直流电一段时间后,左池中溶液的pH上升,右池中溶液的pH下降,不仅a,b两电极放电离子的物质的量相等,且b,c两电极放电离子的物质的量也相等,则电解液应选用下表中的( )
按图电解实验装置(都是惰性电极),若通直流电一段时间后,左池中溶液的pH上升,右池中溶液的pH下降,不仅a,b两电极放电离子的物质的量相等,且b,c两电极放电离子的物质的量也相等,则电解液应选用下表中的( ) 某同学想利用镁与盐酸或醋酸在不同温度下反应,探究外界条件对反应速率的影响.部分实验用表如下:
某同学想利用镁与盐酸或醋酸在不同温度下反应,探究外界条件对反应速率的影响.部分实验用表如下: