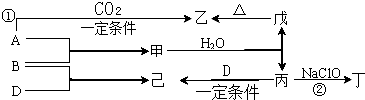
题目内容
硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题.
Ⅰ、如图是某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究的流程和装置.
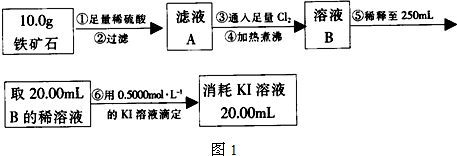
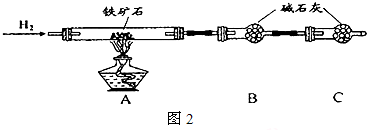
操作步骤如下:
a.按上图2组装仪器(夹持仪器均省略),检查装置的气密性;
b.将5.0g铁矿石放入硬质玻璃管中;
c.从左端导气管口处不断地缓缓通入H2,在C装置出口处收集H2并 后,点燃A处酒精灯;
d.充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却.
e.测得反应后装置B增重1.35g.
回答下列问题:
(1)步骤c中填空为
(2)图1中步骤②和⑤中都要用到的玻璃仪器是 .
(3)下列有关图1中步骤⑥的操作中说法不正确的是 .
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶不需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
(4)由以上实验得出该铁矿石中铁的氧化物的化学式为 .
Ⅱ、硬质玻璃管进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表.

请填写表中的空白:
Ⅰ、如图是某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究的流程和装置.


操作步骤如下:
a.按上图2组装仪器(夹持仪器均省略),检查装置的气密性;
b.将5.0g铁矿石放入硬质玻璃管中;
c.从左端导气管口处不断地缓缓通入H2,在C装置出口处收集H2并
d.充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却.
e.测得反应后装置B增重1.35g.
回答下列问题:
(1)步骤c中填空为
(2)图1中步骤②和⑤中都要用到的玻璃仪器是
(3)下列有关图1中步骤⑥的操作中说法不正确的是
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶不需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
(4)由以上实验得出该铁矿石中铁的氧化物的化学式为
Ⅱ、硬质玻璃管进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表.

请填写表中的空白:
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 棉球变白,微热后又恢复红色 | ||
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
| c | 棉球变为白色 | 结论:该气体具有 |
考点:探究物质的组成或测量物质的含量,铁及其化合物的性质实验
专题:实验设计题
分析:I.(1)在氢气还原金属氧化物时,在点燃酒精灯前要验纯;
(2)根据过滤、稀释液体和配制一定体积的溶液所选择的仪器来回答;
(3)根据滴定实验以及滴定过程中的实验误差分析判断;
(4)反应后装置B增重1.35g,即氢气和氧化铁反应后生成水的质量,据此可计算出氧元素的质量分数;
根据碘元素计算铁元素的质量分数,再根据铁元素质量分数和氧元素质量分数计算出铁的氧化物的化学式;
Ⅱ.a二氧化硫具有漂白性,但其漂白性不稳定,加热时会恢复为原来的颜色;
b.二氧化硫属于酸性氧化物,能和强碱反应生成盐和水;
c.二氧化硫具有还原性,能和碘发生氧化还原反应.
(2)根据过滤、稀释液体和配制一定体积的溶液所选择的仪器来回答;
(3)根据滴定实验以及滴定过程中的实验误差分析判断;
(4)反应后装置B增重1.35g,即氢气和氧化铁反应后生成水的质量,据此可计算出氧元素的质量分数;
根据碘元素计算铁元素的质量分数,再根据铁元素质量分数和氧元素质量分数计算出铁的氧化物的化学式;
Ⅱ.a二氧化硫具有漂白性,但其漂白性不稳定,加热时会恢复为原来的颜色;
b.二氧化硫属于酸性氧化物,能和强碱反应生成盐和水;
c.二氧化硫具有还原性,能和碘发生氧化还原反应.
解答:
解:Ⅰ、(1)氢气中混有氧气时点燃会产生爆炸,为防止安全事故发生,待C装置出口处H2验纯后,点燃A处酒精灯,故答案为:验纯;
(2)过滤需要的玻璃仪器有:烧杯、漏斗、玻璃棒,若稀释到250mL时采用的仪器有:烧杯、玻璃棒、胶头滴管、250mL容量瓶,则两个过程都需要的玻璃仪器有:烧杯、玻璃棒;
故答案为:烧杯、玻璃棒;
(3)a.滴定管用蒸馏水洗涤后再用待装液润洗,否则会导致测量结果偏大,故a正确;
b.锥形瓶不需要用待测液润洗,如果润洗,会导致测量结果偏大,故b正确;
c.碘水为黄色,三价铁离子也是黄色溶液,滴定过程中需加指示剂,故c错误;
故选c;
(4)测的反应后装置B增重1.35g,根据反应的实质,增加的是水的质量,所以氧元素的质量分数是:
×100%=24%,
由于所取溶液(含Fe3+)的体积与消耗KI溶液的体积相等,反应的方程式为2Fe3++2I-=2Fe2++I2,结合方程式可知,c(Fe3+)=c(KI)=0.5mol?L-1,所以铁元素的百分含量为:
×100%=70%,
铁的质量分数是70%,氧元素的质量分数是24%,所以100g铁矿石中,铁元素的质量是70g,氧元素质量是24g,铁元素和氧元素的物质的量比为:
:
=5:6,铁的氧化物的化学式为:Fe5O6,
故答案为:Fe5O6;
Ⅱ.a.红色棉球变白,微热后又恢复红色,说明二氧化硫使品红溶液褪色,则棉球上滴有品红溶液,该实验说明二氧化硫具有漂白性,但其漂白性不稳定,
b.二氧化硫属于酸性氧化物,能和NaOH溶液反应生成亚硫酸钠和水或亚硫酸氢钠,导致溶液碱性减弱,所以棉球变为白色,离子方程式为:SO2+2OH-=SO32-+H2O或OHˉ+SO2=HSO3ˉ;
c.碘遇淀粉试液变蓝色,二氧化硫具有还原性,碘具有氧化性,二者反应生成氢碘酸和硫酸,所以棉球变为白色,离子方程式为:SO2+I2+2H2O=4H++SO42-+2I-,该实验说明二氧化硫具有还原性,
故答案为:
(2)过滤需要的玻璃仪器有:烧杯、漏斗、玻璃棒,若稀释到250mL时采用的仪器有:烧杯、玻璃棒、胶头滴管、250mL容量瓶,则两个过程都需要的玻璃仪器有:烧杯、玻璃棒;
故答案为:烧杯、玻璃棒;
(3)a.滴定管用蒸馏水洗涤后再用待装液润洗,否则会导致测量结果偏大,故a正确;
b.锥形瓶不需要用待测液润洗,如果润洗,会导致测量结果偏大,故b正确;
c.碘水为黄色,三价铁离子也是黄色溶液,滴定过程中需加指示剂,故c错误;
故选c;
(4)测的反应后装置B增重1.35g,根据反应的实质,增加的是水的质量,所以氧元素的质量分数是:
| ||
| 5.0g |
由于所取溶液(含Fe3+)的体积与消耗KI溶液的体积相等,反应的方程式为2Fe3++2I-=2Fe2++I2,结合方程式可知,c(Fe3+)=c(KI)=0.5mol?L-1,所以铁元素的百分含量为:
| 0.5mol/L×0.25L×56g/mol |
| 10g |
铁的质量分数是70%,氧元素的质量分数是24%,所以100g铁矿石中,铁元素的质量是70g,氧元素质量是24g,铁元素和氧元素的物质的量比为:
| 70 |
| 56 |
| 24 |
| 16 |
故答案为:Fe5O6;
Ⅱ.a.红色棉球变白,微热后又恢复红色,说明二氧化硫使品红溶液褪色,则棉球上滴有品红溶液,该实验说明二氧化硫具有漂白性,但其漂白性不稳定,
b.二氧化硫属于酸性氧化物,能和NaOH溶液反应生成亚硫酸钠和水或亚硫酸氢钠,导致溶液碱性减弱,所以棉球变为白色,离子方程式为:SO2+2OH-=SO32-+H2O或OHˉ+SO2=HSO3ˉ;
c.碘遇淀粉试液变蓝色,二氧化硫具有还原性,碘具有氧化性,二者反应生成氢碘酸和硫酸,所以棉球变为白色,离子方程式为:SO2+I2+2H2O=4H++SO42-+2I-,该实验说明二氧化硫具有还原性,
故答案为:
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 品红试液 | ||
| b | 离子方程式:2OHˉ+SO2=SO32ˉ+H2O | ||
| c | 含淀粉的碘水 | 结论:该气体具有还原性 |
点评:本题考查了探究铁矿石中铁和氧元素的含量、二氧化硫的性质,二氧化硫具有还原性、氧化性、漂白性,根据二氧化硫的这几个性质分析解答;铁矿石中成分及其含量的测定中,根据物质的形成从整体上把握知识点,同时考查学生分析问题、解决问题的能力,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列化学用语的书写正确的是( )
| A、NaH2PO4的水解:H2PO4-+H2O?H3O++HPO42- |
| B、H2S在水中的电离:H2S?2H++S2- |
| C、Na2SO3的水解:SO32-+H2O?HSO3-+OH- |
| D、CH3COONa在水中的电离:CH3COONa?CH3COO-+Na+ |
下列各组物质只用一种试剂不能全部检验出来的是( )
| A、甲苯、氯仿、己烯、酒精、苯酚水溶液、纯碱 |
| B、五瓶无色溶液:乙醇、乙醛、乙酸、葡萄糖、丙三醇 |
| C、四瓶无色液体:己烯、环己烷、溴乙烷、苯 |
| D、四瓶无色溶液:CCl4、苯乙烯、乙醇、苯酚溶液 |
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的情况.下列反应中属于这种情况的是( )
| A、过量的浓盐酸与MnO2反应 |
| B、过量的Zn与18 mol/L的硫酸反应 |
| C、过量的Fe与稀硝酸反应 |
| D、过量的H2与N2在催化剂存在下反应 |
一定量的混合气体在密闭容器中发生反应 m A (g)+n B (g)?p C (g)达到平衡后,温度不变,将气体体积缩小到原来的
,达到平衡时,C的浓度为原来的2.5倍,则下列说法不正确的是( )
| 1 |
| 2 |
| A、m+n>p |
| B、C的体积分数增加 |
| C、平衡向正反应方向移动 |
| D、A 的转化率降低 |