题目内容
取一定质量的均匀固体混合物Cu、Cu2O和 CuO,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为( )
| A、3.2mol/L |
| B、2.8mol/L |
| C、1.8mol/L |
| D、缺数据无法计算 |
考点:化学方程式的有关计算
专题:计算题
分析:将Cu2O拆分为Cu、CuO,原混合物看做Cu、CuO的混合物,其中一份用足量的氢气还原,反应后固体质量减少6.40g为拆分后Cu、CuO的混合物中O元素的质量,O原子的物质的量为
=0.4mol,根据Cu元素守恒可知n(CuO)=n(O)=0.4mol;另一份中加入500mL稀硝酸,固体恰好完全溶解,溶液中溶质为Cu(NO3)2,且同时收集到标准状况下NO气体4.48L,NO的物质的量为
=0.2mol,根据电子转移守恒可知拆分后Cu、CuO的混合物中2n(Cu)=3n(NO),由铜元素守恒可知n[Cu(NO3)2]=n(CuO)+n(Cu),根据氮元素守恒可知n(HNO3)=n(NO)+2n[Cu(NO3)2],据此计算n(HNO3),再根据c=
计算硝酸的浓度.
| 6.4g |
| 16g/mol |
| 4.48L |
| 22.4L/mol |
| n |
| V |
解答:
解:将Cu2O拆分为Cu、CuO,原混合物看做Cu、CuO的混合物,其中一份用足量的氢气还原,反应后固体质量减少6.40g为拆分后Cu、CuO的混合物中O元素的质量,O原子的物质的量为
=0.4mol,根据Cu元素守恒可知n(CuO)=n(O)=0.4mol;
另一份中加入500mL稀硝酸,固体恰好完全溶解,溶液中溶质为Cu(NO3)2,且同时收集到标准状况下NO气体4.48L,NO的物质的量为
=0.2mol,
根据电子转移守恒可知拆分后Cu、CuO的混合物中2n(Cu)=3n(NO)=3×0.2mol,n(Cu)=0.3mol,
由铜元素守恒可知n[Cu(NO3)2]=n(CuO)+n(Cu)=0.4mol+0.3mol=0.7mol,
根据氮元素守恒可知n(HNO3)=n(NO)+2n[Cu(NO3)2]=0.2mol+2×0.7mol=1.6mol,硝酸的浓度为
=3.2mol/L.
故选A.
| 6.4g |
| 16g/mol |
另一份中加入500mL稀硝酸,固体恰好完全溶解,溶液中溶质为Cu(NO3)2,且同时收集到标准状况下NO气体4.48L,NO的物质的量为
| 4.48L |
| 22.4L/mol |
根据电子转移守恒可知拆分后Cu、CuO的混合物中2n(Cu)=3n(NO)=3×0.2mol,n(Cu)=0.3mol,
由铜元素守恒可知n[Cu(NO3)2]=n(CuO)+n(Cu)=0.4mol+0.3mol=0.7mol,
根据氮元素守恒可知n(HNO3)=n(NO)+2n[Cu(NO3)2]=0.2mol+2×0.7mol=1.6mol,硝酸的浓度为
| 1.6mol |
| 0.5L |
故选A.
点评:本题考查混合物的计算、守恒计算等,题目难度中等,清楚反应过程是解题的关键,本题采取拆分法解答,简化计算过程,注意体会,可以通过列方程解答.

练习册系列答案
相关题目
在含有1mol KAl(SO4)2的溶液中逐滴加入含有2mol Ba(OH)2的溶液,下列有关说法中正确的是( )
| A、先生成沉淀,后沉淀全部溶解 |
| B、当溶液中A13+全部沉淀出来时,沉淀的总物质的量最大 |
| C、当溶液中A13+全部沉淀出来时,沉淀质量开始减少 |
| D、最后的沉淀为2mol BaSO4,1mol Al(OH)3 |
下列防止金属腐蚀的做法不可行的是( )
| A、自行车的钢圈和车铃上镀上一层铬,既耐腐蚀又美观耐磨 |
| B、衣架和电线外面包上一层塑料层以防锈 |
| C、在钢材制造的大型船舶上装上一定数量的锌块 |
| D、在某些工具的机械转动部位刷油漆以防锈 |

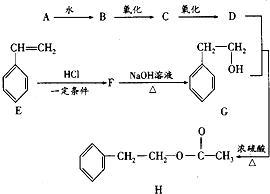 乙酸苯乙酯是一种具有玫瑰花香,并带有可可香韵的有机物,常用于调配玫瑰、橙花、紫罗兰、晚香玉、野蔷薇等香精.天然乙酸苯乙酯存在于白兰花油和玫瑰花油中,也可通过化学方法合成.如图是一种合成路线(部分反应物和条件省略).
乙酸苯乙酯是一种具有玫瑰花香,并带有可可香韵的有机物,常用于调配玫瑰、橙花、紫罗兰、晚香玉、野蔷薇等香精.天然乙酸苯乙酯存在于白兰花油和玫瑰花油中,也可通过化学方法合成.如图是一种合成路线(部分反应物和条件省略).