题目内容
15.卤族元素指周期系ⅦA族元素.包括氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At),简称卤素.它们在自然界都以典型的盐类存在,是成盐元素.(1)请绘制碘原子的外围电子排布图
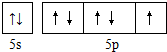 .
.(2)下列图1曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是a.
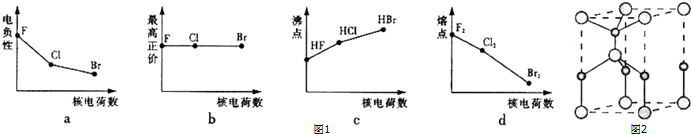
(3)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,图2为其晶胞结构示意图,则每个晶胞中含有B原子的个数为2,该功能陶瓷的化学式为BN.
(4)BCl3和NCl3其中心原子的杂化方式分别为sp2和sp3.第一电离能介于B、N之间的第二周期元素有3种.ClO3-、ClO4-中Cl都是以sp3杂化轨道与O原子成键的,其微粒的立体结构分别为三角锥形、正四面体形.
(5)已知氯化铝的熔点为190℃(2.02×105Pa),但它在180℃和常压下即开始升华,则氯化铝是分子晶体(填“离子”或“分子”).设计一个更可靠的实验,证明氯化铝是离子晶体还是分子晶体,你的实验是在加压条件下加热至熔融,测其导电性,若导电,则是离子晶体,若不导电,则为分子晶体.
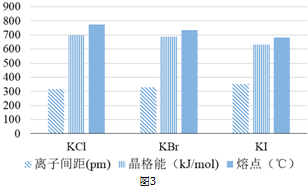
(6)图3给出了一些卤化钾晶体的离子间距、晶格能、熔点等数据.请根据图中的数据说明这些卤化钾晶体的离子间距、熔点与晶格能之间的关系晶格能的大小与阴、阳离子间的距离成反比,晶格能愈大,晶体的熔点愈高.
分析 (1)碘位于第五周期,最外层电子数为7;
(2)a.卤族元素元素非金属性越强其电负性越大;
b.F元素没有正化合价;
c.卤族元素氢化物沸点随着原子序数增大而增大,但含有氢键的卤化氢沸点最高;
d.卤族元素单质的熔点随着原子序数增大而增大;
(3)利用均摊法计算原子个数,两种元素原子个数最简比确定化学式;
(4)根据价层电子对互斥理论确定原子杂化方式,同一周期元素中,元素第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素;
(5)由信息可知氯化铝的熔沸点低,由分子构成,共价化合物熔化状态下不导电;
(6)由图可知,KCl、KBr、KI的离子间距逐渐增大、晶格能和熔点在逐渐减小.
解答 解:(1)碘位于第五周期,最外层电子数为7,则碘原子的外围电子排布图 ,故答案为:
,故答案为: ;
;
(2)a.卤族元素元素非金属性越强其电负性越大,卤族元素非金属性随着原子序数增大而增大,所以电负性随着原子序数增大而增大,故正确;
b.F元素没有正化合价,其它卤族元素最高正价为+7价,故错误;
c.卤族元素氢化物沸点随着原子序数增大而增大,但含有氢键的卤化氢沸点最高,HF中存在氢键,所以沸点最高,故错误;
d.卤族元素单质的熔点随着原子序数增大而增大,故错误;
故答案为:a;
(3)根据原子半径大小知,B原子半径大于N原子,所以大球表示B原子,利用均摊法得B原子个数=1+8×$\frac{1}{8}$=2,N原子个数=1+4×$\frac{1}{4}$=2,B原子和N原子个数之比为2:2=1:1,所以其化学式为BN,故答案为:2;BN;
(4)BCl3分子中B原子价层电子对个数=3+$\frac{1}{2}$×(3-3×1)=3且不含孤电子对,所以B原子采用sp2杂化;NCl3中中心原子价层电子对个数3+$\frac{1}{2}$×(5-3×1)=4且含有一个孤电子对,所以N原子的杂化方式为sp3;
同一周期元素中,元素第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,所以第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素;
ClO3-、ClO4-中Cl都是以sp3杂化轨道与O原子成键的,ClO3-中3+$\frac{1}{2}$×(7+1-3×2)=4(含1对孤对电子),ClO4-中4+$\frac{1}{2}$×(7+1-2×4)=4(不含孤对电子),其微粒的立体结构分别为三角锥形、正四面体形,
故答案为:sp2;sp3;3;三角锥形;正四面体形;
(5)由氯化铝的熔点为190℃(2.02×105Pa),但它在180℃和常压下即开始升华,则氯化铝是分子晶体.设计一个更可靠的实验,证明氯化铝是离子晶体还是分子晶体,实验方法为在加压条件下加热至熔融,测其导电性,若导电,则是离子晶体,若不导电,则为分子晶体,
故答案为:分子;在加压条件下加热至熔融,测其导电性,若导电,则是离子晶体,若不导电,则为分子晶体;
(6)由图可知,KCl、KBr、KI的离子间距逐渐增大、晶格能和熔点在逐渐减小,则卤化钾晶体的离子间距、熔点与晶格能之间的关系为晶格能的大小与阴、阳离子间的距离成反比,晶格能愈大,晶体的熔点愈高,
故答案为:晶格能的大小与阴、阳离子间的距离成反比,晶格能愈大,晶体的熔点愈高.
点评 本题考查晶胞计算、杂化理论及晶体类型和性质等,为高频考点,把握原子结构与性质、晶体类型与性质等为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度中等.

 东晋葛洪《肘后备急方》一书中记载:“青蒿一握,以水二升渍,绞取汁,尽服之”. 屠呦呦团队在世界率先确定了青蒿素结构式如图所示.下列说法错误的是
东晋葛洪《肘后备急方》一书中记载:“青蒿一握,以水二升渍,绞取汁,尽服之”. 屠呦呦团队在世界率先确定了青蒿素结构式如图所示.下列说法错误的是( )
| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿乃中药,宜采取水煎煮熬汁的方法服用 | |
| C. | 青蒿素难溶于水,提取的方法是用有机溶剂萃取 | |
| D. | 青蒿素分子中有2种非极性键和3种极性键 |
| A. | 食品包装内常放置具有吸水性的化学药品以保持干燥,如五氧化二磷和硅胶 | |
| B. | 青蒿素在超临界CO2中有很强的溶解性,萃取青蒿素可用超临界CO2作萃取剂 | |
| C. | 利用太阳能电池板发电,不发生化学变化 | |
| D. | 在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 |
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,价电子的电子排布式3s23p5,价电子所在电子层的轨道数9.
②LiBH4由Li+和BH4-构成,BH4-的空间构型是正四面体,B原子的杂化轨道类型是sp3.
③Li、B元素的第一电离能由大到小排列顺序为B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<H-(填“>”、“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞边长a=480pm,Na+半径为104pm,H-的半径为136pm,NaH的理论密度是$\frac{96}{(4.8×1{0}^{-8})^{3}{N}_{A}}$g•cm-3.(用NA表示)
| A. | 用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,说明溶液中含有K+ | |
| B. | 向某无色溶液中滴加BaCl2溶液有白色沉淀出现,说明该溶液中一定含有SO42- | |
| C. | 向某溶液中加AgNO3溶液和稀盐酸,有白色沉淀出现,说明该溶液中一定含有Cl- | |
| D. | 向某溶液中加NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,说明该溶液中一定含有NH4+ |
| A. | 18g D2O含有电子数为10NA | |
| B. | 常温下,4.6 g Na和足量的O2完全反应失去电子数为0.2NA | |
| C. | 标准状况下,11.2 LNO和11.2 L O2混合后气体的分子总数为NA | |
| D. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
 )是合成高分子化合物M的单体,H可以通过有机物A(分子式为C7H8O)和丙酮为原料来进行合成,E为中间产物(结构简式为
)是合成高分子化合物M的单体,H可以通过有机物A(分子式为C7H8O)和丙酮为原料来进行合成,E为中间产物(结构简式为 )其合成路线如图:
)其合成路线如图:
 $→_{催化剂}^{O_{2}}$
$→_{催化剂}^{O_{2}}$
 .
. +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$ )是临床上一种降脂抗血栓药物,它的一条合成路线如下:
)是临床上一种降脂抗血栓药物,它的一条合成路线如下:

 .
. .
. 含硅元素的化合物广泛存在于自然界中,与其他矿物共同构成岩石.晶体硅(熔点 1410℃)用途广泛,制取与提纯方法有多种.
含硅元素的化合物广泛存在于自然界中,与其他矿物共同构成岩石.晶体硅(熔点 1410℃)用途广泛,制取与提纯方法有多种.