题目内容
16.化学中的pH表示物体的酸碱程度,其定义为pH=-1g[H+],这里的[H+]为每升中氢离子的浓度.求出下列物体的pH:(1)醋:[H+]≈6.3×10-3(2)胡萝卜:[H+]≈1.0×10-5.
(3)已知海水的pH为8.3,求海水的氢离子的浓度.
分析 根据pH=-1g[H+]计算溶液的pH或[H+],以此解答.
解答 解:(1)醋:[H+]≈6.3×10-3.则pH=-lg6.3×10-3=3-lg6.3=2.2,答:pH=2.2;
(2)胡萝卜:[H+]≈1.0×10-5.则pH=-lg1.0×10-5=5,答:pH=5;
(3)海水的pH为8.3,则[H+]=10-8.3mol/L,答:海水的氢离子的浓度为10-8.3mol/L.
点评 本题考查pH的计算,为高频考点,侧重于学生的计算能力的考查,注意把握相关计算公式的运用,难度不大.

练习册系列答案
相关题目
6.双酚A是食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.下列有关双酚A的叙述不正确的是( )
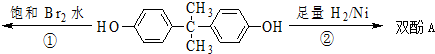

| A. | 双酚A的分子式是C15H16O2 | |
| B. | 双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3 | |
| C. | 反应①中,1 mol双酚A最多消耗4mol Br2 | |
| D. | 反应②的产物中有两种官能团 |
7.下列实验能获得成功的是( )
| A. | 制备溴苯时,将苯与溴水混合,剧烈振荡 | |
| B. | 除去甲烷中混有的二氧化碳时,依次通过烧碱溶液和浓硫酸 | |
| C. | 在酸性高锰酸钾溶液中滴加几滴苯,用力振荡,紫红色褪去 | |
| D. | 在苯中铜氢气制备环己烷 |
4.用NA表示阿伏加德罗常数的值,下列判断正确的是( )
| A. | 44gN2O含有的氮原子数目为NA | |
| B. | 常温常压下,22.4 L N2含有的分子数目为NA | |
| C. | 1 mol Mg变为Mg2+时失去的电子数目为2NA | |
| D. | lmol•L-1K2CO3,溶液中含有的钾离子数目为NA |
11.已知:3H2+N2═2NH3为放热反应,对该反应的下列说法中正确的是( )
| A. | N2和H2的总能量一定大于NH3的总能量 | |
| B. | 因该反应为放热反应,故不必加热就可发生 | |
| C. | N2和H2的总能量一定低于NH3的总能量 | |
| D. | NH3的能量一定高于N2的能量 |
1.纯水中存在如下平衡:H2O?H++OH-△H>0,当改变条件时,填写表中各项内容.
| 改变条件 | 平衡移动方向 | pH | 水电离出的c(H+) | KW |
| 升温 | ||||
| 通入HCl气体 | ||||
| 加入NaOH固体 | ||||
| 加入NH4Cl固体 | ||||
| 加入金属钠 |
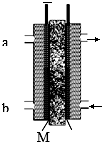 甲醇是燃料电池的常见原料,现以熔融的K2CO3为电解质,以甲醇为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.图是甲醇燃料电池模型,试回答下列问题:
甲醇是燃料电池的常见原料,现以熔融的K2CO3为电解质,以甲醇为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.图是甲醇燃料电池模型,试回答下列问题:
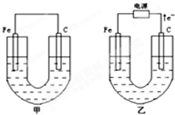 甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题: