题目内容
9.在下列分子中,各主族元素原子均达到稳定结构.I.氧硫化碳(CSO)可替代磷化氢(化学式:PH3,剧毒)而被用作熏蒸剂.
(1)在基态硫原子中,电子占据的最高能层符号为M,在上述5种元素中,第一电离能比同周期相邻原子都大的元素是P.
(2)氧硫化碳(CSO)分子的电子式为:
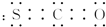 ,其分子呈直线形.
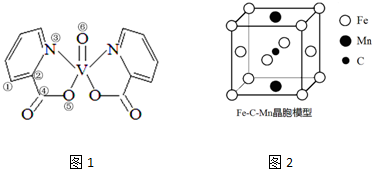
,其分子呈直线形.II.研究发现,钒元素的某种配合物可增强胰岛素降糖作用,该分子具有立体结构,如图1所示如下.
(3)钒元素23V的基态价层电子轨道表示式是
 .
.(4)分子中采取sp2杂化的原子有①②③④(填序号).1mol分子中含有配位键的数目是2NA.
(5)在该分子中,同一平面内最多可具有的原子数是27.
III.Fe-C-Mn合金的一种晶胞为正立方结构如图2所示.
(6)与一个锰(Mn)原子配位的Fe原子的数目为12.
(7)已知该晶体的密度为ρg•cm-3,用NA表示阿伏伽德罗常数的值,则该晶胞的边长为$\root{3}{\frac{235}{{N}_{A}ρ}}$cm.
分析 I.(1)在基态硫原子中,其最外层电子排布为3s23p4,在周期表中第ⅡA族和第ⅤA族元素的第一电离能比同周期相邻原子都大,据此答题;
(2)氧硫化碳(CSO)分子中碳、硫和碳、氧之间都有两对共用电子对,碳是sp杂化,没有孤电子对,据此判断分子构型;
II.(3)基态V元素的价层电子排布式为3d34s2,结合泡利原、洪特规则画出轨道表示式;
(4)采取sp2杂化的原子杂化轨道数目为3,而杂化轨道数目=σ键+孤对电子;V与N原子之间形成配位键;
(5)根据图1可知,杂环上所有的原子可以共面,碳氧双键上的所有原子共面,矾原子周围及矾原子最多可以有5个原子共面,据此判断;
III.(6)根据晶胞结构,可知与上底面面心上的锰原子距离最近的铁原子位于该底面的四个顶点及侧面的面心,共有12个,
(7)根据晶胞的结构,利用均摊法计算晶胞中Fe、C、Mn原子数目,m=ρV计算晶胞棱长;
解答 解:I.(1)在基态硫原子中,其最外层电子排布为3s23p4,所以占据的最高能层符号为M,在周期表中第ⅡA族和第ⅤA族元素的第一电离能比同周期相邻原子都大,所以在C、S、O、P、H中,第一电离能比同周期相邻原子都大的元素是P,
故答案为:M;P;
(2)氧硫化碳(CSO)分子中碳、硫和碳、氧之间都有两对共用电子对,其电子式为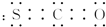 ,碳是sp杂化,没有孤电子对,所以其分子呈直线形,
,碳是sp杂化,没有孤电子对,所以其分子呈直线形,
故答案为: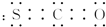 ;直线;
;直线;
II.(3)基态V元素的价层电子排布式为3d34s2,轨道表示式为 ,
,
故答案为: ;
;
(4)分子中C原子、N原子σ键均为3,均没有孤电子对,杂化轨道数目均为3,均采取sp2杂化,故选①②③④,V与N原子之间形成配位键,1mol分子含有2mol配位键,即含有2NA个配位键,
故答案为:①②③④;2NA;
(5)根据图1可知,杂环上所有的原子可以共面,碳氧双键上的所有原子共面,矾原子周围及矾原子最多可以有5个原子共面,所以同一平面内最多可具有的原子数是27,
故答案为:27;
III.(6)根据晶胞结构,可知与上底面面心上的锰原子距离最近的铁原子位于该底面的四个顶点及侧面的面心,共有12个,所以与一个锰(Mn)原子配位的Fe原子的数目为12,
故答案为:12;
(7)根据晶胞的结构,可知晶胞中Fe原子数为8×$\frac{1}{8}+4×\frac{1}{2}$=3,C原子数为1,Mn原子数目为$2×\frac{1}{2}$=1,根据m=ρV可知,晶胞棱长=$\root{3}{\frac{m}{ρ}}$=$\root{3}{\frac{\frac{3×56+12+55}{{N}_{A}}}{ρ}}$=$\root{3}{\frac{235}{{N}_{A}ρ}}$cm,
故答案为:$\root{3}{\frac{235}{{N}_{A}ρ}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、第一电离能、化学键、共线共面问题、晶胞结构及有关计算,掌握均摊法进行有关晶胞计算.

| A. | 再生塑料 | B. | 人造皮革 | C. | 钢化玻璃 | D. | 玻璃钢 |
| A. | 微粒观:二氧化碳是由碳原子和氧原子构成的 | |
| B. | 转化观:升高温度可以将不饱和硝酸钾溶液转变为饱和 | |
| C. | 守恒观:1g镁与1g稀硫酸充分反应后所得的溶液质量为2g | |
| D. | 结构观:金刚石和石墨由于结构中碳原子的排列方式不同,性质存在着较大的差异 |
| A. | CO的摩尔质量是28g | |
| B. | 1mol CO中所含分子数为6.02×1023个 | |
| C. | 1 mol CO的质量是28 g/mol | |
| D. | 常温常压下,1 mol CO的体积为22.4 L |
| A. | 分子晶体中范德华力没有方向性和饱和性,所以分子晶体一般都采取密堆积,但要受到分子形状的影响 | |
| B. | 由于共价键的方向性和饱和性,原子晶体堆积的紧密程度大大降低 | |
| C. | 配位数就是配位键的数目 | |
| D. | 离子晶体一般都是非等径球的密堆积 |
| A. | 钠铝合金 | B. | Na2O和Al2O3 | C. | 明矾和BaO | D. | MgO和SO3 |
| A. | NaOH | B. | H2O | C. | MgCl2 | D. | Na2O2 |
| A. | 稀硫酸与氢氧化钡溶液反应:SO42-+Ba2+═Ba SO4↓ | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 石灰石溶于稀盐酸:CO32-+2H+=+CO2↑+H2O | |
| D. | 氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++Cu |