题目内容
13.已知:5H2C2O4+2KMnO4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O实验室有瓶混有泥沙的草酸样品,某同学利用这个反应的原理来测定其含量,具体操作为①准确称量5.0g草酸样品,配成250mL溶液.
②准确量取25.00mL所配溶液于锥形瓶中,加少量H2SO4酸化,将0.1000mol/LKMnO4溶液装入酸式滴定管(填仪器名称),进行滴定,记录数据,重复滴定3次,平均消耗KMnO4溶液20.00mL,
③计算此样品中草酸的质量分数为90%(已知H2C2O4的相对分子质量为90).
④若步骤②滴定管用蒸馏水洗涤后直接装入0.1000mol/LKMnO4溶液,则测定出的草酸含量将(填“无影响”、“偏高”或“偏低”,下同)偏高.
⑤若滴定前仰视读取数据,滴定后平视读取数据,则测定出草酸含量将偏低.
分析 ②高锰酸钾溶液具有氧化性,能腐蚀橡胶管;
③依据反应的定量关系计算,5H2C2O4+2KMnO4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O注意溶液体积变化;
④若步骤②滴定管用蒸馏水洗涤后直接装入0.1000mol/LKMnO4溶液,会稀释高锰酸钾溶液,滴定过程中消耗标准溶液体积增大;
⑤若滴定前仰视读取数据,读取起始数值增大,滴定后平视读取数据,则计算得到消耗标准溶液体积减小.
解答 解:①准确称量5.0g草酸样品,配成250mL溶液.
②高锰酸钾溶液具有氧化性,能腐蚀橡胶管,不能盛装碱式滴定管,准确量取25.00mL所配溶液于锥形瓶中,加少量H2SO4酸化,将0.1000mol/LKMnO4溶液装入酸式滴定管,
故答案为:酸式滴定管;
③5H2C2O4+2KMnO4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O,设溶液浓度为c,
5 2
0.025L×c 0.1000mol/L×0.020.00L
c=0.2mol/L,
250mL溶液中所含草酸物质的量=0.25L×0.2mol/L=0.05mol,
样品中草酸的质量分数=
故答案为:$\frac{0.05mol×90g/mol}{5.0g}$×100%=90%,
故答案为:90%;
④若步骤②滴定管用蒸馏水洗涤后直接装入0.1000mol/LKMnO4溶液,会稀释高锰酸钾溶液,滴定过程中消耗标准溶液体积增大,测定溶液浓度偏高,
故答案为:偏高;
⑤若滴定前仰视读取数据,读取起始数值增大,滴定后平视读取数据,则计算得到消耗标准溶液体积减小,测定溶液浓度偏低,
故答案为:偏低.
点评 本题考查了滴定实验的过程分析,定量计算和仪器使用,掌握基础是解题关键,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 稳定性:H2S>HF | B. | HCl的电子式: | ||
| C. | 在卤化氢中HI最稳定 | D. | 沸点:PH3>NH3 |
| A. | 简单立方堆积 | B. | 体心立方堆积 | C. | 面心立方堆积 | D. | 六方堆积 |
下列有关说法正确的是( )
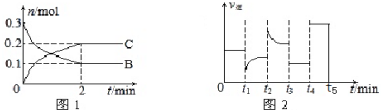
| A. | x=2.反应开始2min内,v(A)=0.05 mol•L-1•min-1 | |
| B. | 若tl时改变的条件是降温,平衡正向移动,则该反应为放热反应 | |
| C. | 若t2时改变的条件是增大c的浓度,则t2时正反应速率减小 | |
| D. | t3-t5时间段B的浓度一定未发生变化 |
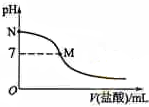 298K时,在20.0mL 0.10mol•L-1氨水中滴入0.10mol•L-的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10mol•L-1氨水的电离度为1.32%,下列有关叙述正确的是( )
298K时,在20.0mL 0.10mol•L-1氨水中滴入0.10mol•L-的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10mol•L-1氨水的电离度为1.32%,下列有关叙述正确的是( )| A. | 该滴定过程应该选择石蕊作为指示剂 | |
| B. | M点对应的盐酸体积为20.0 mL | |
| C. | M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-) | |
| D. | N点处的溶液中pH<12 |
| A. | ①②③④ | B. | ①②⑤⑥ | C. | ③⑤⑥⑦ | D. | ①③④⑦ |
| A. | 一定等于0.01 | B. | 一定大于0.01 | ||
| C. | 一定大于或等于0.01 | D. | 可能小于0.01 |
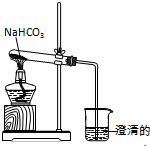 实验室利用图所示装置进行NaHCO3的受热分解实验.
实验室利用图所示装置进行NaHCO3的受热分解实验.