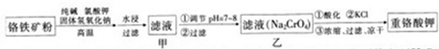
题目内容
氯化亚铜在工业上应用广泛.利用反应Cu2++Cu+2Cl-=2CuCl制氯化亚铜的流程如下图.氯化亚铜(CuC1)为白色晶体,不溶于硫酸、稀硝酸和醇,微溶于水,在空气中会被迅速氧化,能溶于浓盐酸,并生成配合物,该配合物加水稀释后会重新析出CuCl沉淀.
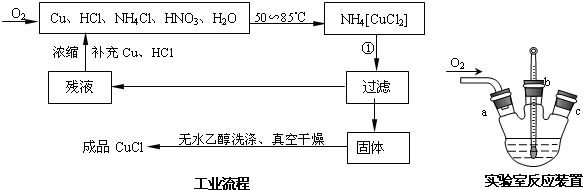
实验药品:铜丝20g、氯化铵20g、65% 硝酸10mL、36%盐酸15mL、水.
(1)反应①的化学方程式为 .
(2)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装.真空干燥,密封包装的
目的是 .
(3)工业化生产时,乙醇可通过 方法回收并循环利用,而NH4Cl、 (填化学式)可直接循环利用.
(4)实验室用如图装置制备CuCl.实验开始时,温度计显示反应液温度低于室温,主要原因是 ,电炉加热升温至50℃时停止加热,反应快速进行,烧瓶上方气体颜色逐渐由无色变为红棕色,从环保角度考虑,当 时才能停止通入氧气.
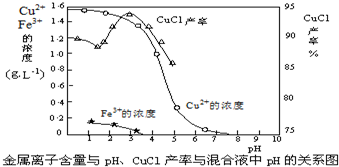
(5)氯化亚铜在工业上也可以利用酸性电镀废液(主要含Cu2+、Fe3+)制得高浓度硫酸铜溶液后,加入铁粉、氯化钠生成CuCl.反应的离子反应方程式为: .
CuCl产率与混合液pH的关系如图,析出CuCl晶体时的最佳pH在 左右.

实验药品:铜丝20g、氯化铵20g、65% 硝酸10mL、36%盐酸15mL、水.
(1)反应①的化学方程式为
(2)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装.真空干燥,密封包装的
目的是
(3)工业化生产时,乙醇可通过
(4)实验室用如图装置制备CuCl.实验开始时,温度计显示反应液温度低于室温,主要原因是
(5)氯化亚铜在工业上也可以利用酸性电镀废液(主要含Cu2+、Fe3+)制得高浓度硫酸铜溶液后,加入铁粉、氯化钠生成CuCl.反应的离子反应方程式为:
CuCl产率与混合液pH的关系如图,析出CuCl晶体时的最佳pH在

考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)依据流程分析NH4[CuCl2]分解产物过滤后得到滤液为氯化铵,固体为CuCl,结合原子守恒写出化学方程式;
(2)由题给信息可知CuCl微溶于水,不溶于乙醇,在空气中会被迅速氧化;
(3)依据乙醇沸点低利用蒸馏方法回收利用,制备过程中的氯化铵和硝酸直接利用;
(4)制备氯化亚铜所用的原料中含有氯化铵溶解过程中吸热,生成的红棕色气体二氧化氮污染气体不能排放,需要通入氧气至恰好吸收生成硝酸循环使用;
(5)在硫酸铜溶液中加入氯化钠、铁,发生氧化还原反应生成CuCl;由图可知,析出CuCl沉淀的最佳pH应为CuCl的产率最大,且氢氧化铁杂质较少.
(2)由题给信息可知CuCl微溶于水,不溶于乙醇,在空气中会被迅速氧化;
(3)依据乙醇沸点低利用蒸馏方法回收利用,制备过程中的氯化铵和硝酸直接利用;
(4)制备氯化亚铜所用的原料中含有氯化铵溶解过程中吸热,生成的红棕色气体二氧化氮污染气体不能排放,需要通入氧气至恰好吸收生成硝酸循环使用;
(5)在硫酸铜溶液中加入氯化钠、铁,发生氧化还原反应生成CuCl;由图可知,析出CuCl沉淀的最佳pH应为CuCl的产率最大,且氢氧化铁杂质较少.
解答:
解:(1)NH4[CuCl2]分解产物过滤后得到滤液为氯化铵,固体为CuCl,反应的化学方程式为NH4[CuCl2]=CuCl↓+NH4Cl,故答案为:NH4[CuCl2]=CuCl↓+NH4Cl;
(2)由题给信息可知CuCl微溶于水,不溶于乙醇,在空气中会被迅速氧化,为防止氧化应隔绝空气,在干燥、真空环境中可加快乙醇和水的蒸发,
故答案为:加快乙醇和水的蒸发,防止CuCl被空气氧化;
(3)根据乙醇的沸点较低,可以利用蒸馏的方法回收乙醇循环利用,反应过程中的氯化铵和硝酸可以在混合液中 直接利用,
故答案为:蒸馏;HNO3;
(4)制备氯化亚铜所用的原料为Cu、HCl、NH4Cl、HNO3、H2O,其中含有氯化铵溶解过程中吸热,反应过程中生成的红棕色气体二氧化氮污染气体不能排放,需要通入氧气至恰好吸收生成硝酸循环使用,4NO2+O2+2H2O=4HNO3,故答案为:氯化铵溶于水吸收大量热量,造成反应液温度降低;烧瓶上方红棕色气体逐渐变为无色;
(5)在硫酸铜溶液中加入氯化钠、铁,发生氧化还原反应生成CuCl,发生2Cu2++2Cl-+Fe=2CuCl↓+Fe2+;由图可知,析出CuCl沉淀的最佳pH应为CuCl的产率最大,且氢氧化铁杂质较少,应约为3左右,故答案为:2Cu2++2Cl-+Fe=2CuCl↓+Fe2+;3.
(2)由题给信息可知CuCl微溶于水,不溶于乙醇,在空气中会被迅速氧化,为防止氧化应隔绝空气,在干燥、真空环境中可加快乙醇和水的蒸发,
故答案为:加快乙醇和水的蒸发,防止CuCl被空气氧化;
(3)根据乙醇的沸点较低,可以利用蒸馏的方法回收乙醇循环利用,反应过程中的氯化铵和硝酸可以在混合液中 直接利用,
故答案为:蒸馏;HNO3;
(4)制备氯化亚铜所用的原料为Cu、HCl、NH4Cl、HNO3、H2O,其中含有氯化铵溶解过程中吸热,反应过程中生成的红棕色气体二氧化氮污染气体不能排放,需要通入氧气至恰好吸收生成硝酸循环使用,4NO2+O2+2H2O=4HNO3,故答案为:氯化铵溶于水吸收大量热量,造成反应液温度降低;烧瓶上方红棕色气体逐渐变为无色;
(5)在硫酸铜溶液中加入氯化钠、铁,发生氧化还原反应生成CuCl,发生2Cu2++2Cl-+Fe=2CuCl↓+Fe2+;由图可知,析出CuCl沉淀的最佳pH应为CuCl的产率最大,且氢氧化铁杂质较少,应约为3左右,故答案为:2Cu2++2Cl-+Fe=2CuCl↓+Fe2+;3.
点评:本题考查了物质制备的流程分析和反应产物判断,反应条件、反映实际的选择,反应过程中物质循环利用的绿色化学思想,题目难度中等.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
下列说法正确的是( )
①漂白粉、水玻璃和铝热剂都是混合物;
②煤的干馏和石油的分馏都是化学变化;
③氨基酸、纯碱、芒硝和生石灰分别属于酸、碱、盐和氧化物;
④非极性键也可能存在于离子化合物中.
①漂白粉、水玻璃和铝热剂都是混合物;
②煤的干馏和石油的分馏都是化学变化;
③氨基酸、纯碱、芒硝和生石灰分别属于酸、碱、盐和氧化物;
④非极性键也可能存在于离子化合物中.
| A、①④ | B、①③ | C、②④ | D、③④ |
已知热化学方程式:Zn(s)+
O2═ZnO(s)△H=-akJ?mol-1 2Hg(l)+O2(g)═2HgO(s)△H=-bkJ.mol-1由此可知Zn(s)+HgO(s)═ZnO(s)+Hg(l)△H=( )
| 1 |
| 2 |
A、
| ||
B、
| ||
| C、2a-bkJ?mol-1 | ||
| D、b-2akJ?mol |
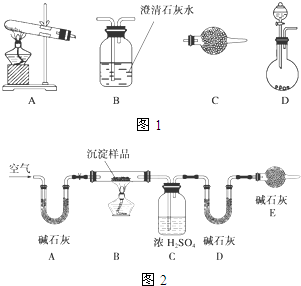 某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀.甲同学认为两者反应只生成CuCO3一种沉淀;乙同学认为这两者相互促进水解,只生成Cu(OH)2一种沉淀;丙同学认为生成CuCO3和Cu(OH)2两种沉淀.(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀.甲同学认为两者反应只生成CuCO3一种沉淀;乙同学认为这两者相互促进水解,只生成Cu(OH)2一种沉淀;丙同学认为生成CuCO3和Cu(OH)2两种沉淀.(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
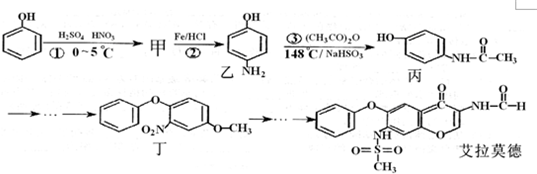
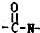 ,所以它属于二肽
,所以它属于二肽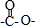 结构且能发生银镜反应 ②N原子直接与苯环相连③核磁共振氢谱有5种峰且峰面积比1:1:2:2:3,
结构且能发生银镜反应 ②N原子直接与苯环相连③核磁共振氢谱有5种峰且峰面积比1:1:2:2:3,