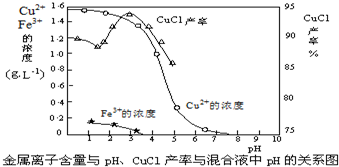
题目内容
已知热化学方程式:Zn(s)+
O2═ZnO(s)△H=-akJ?mol-1 2Hg(l)+O2(g)═2HgO(s)△H=-bkJ.mol-1由此可知Zn(s)+HgO(s)═ZnO(s)+Hg(l)△H=( )
| 1 |
| 2 |
A、
| ||
B、
| ||
| C、2a-bkJ?mol-1 | ||
| D、b-2akJ?mol |
考点:用盖斯定律进行有关反应热的计算
专题:
分析:根据盖斯定律,利用已知的热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的加减.
解答:
解:已知:①Zn(s)+
O2═ZnO(s)△H=-akJ?mol-1
②2Hg(l)+O2(g)═2HgO(s)△H=-bkJ.mol-1根据盖斯定律,
得Zn(s)+HgO(s)=ZnO(s)+Hg(l),
则△H=
kJ?mol-1=
kJ?mol-1,
故选B.
| 1 |
| 2 |
②2Hg(l)+O2(g)═2HgO(s)△H=-bkJ.mol-1根据盖斯定律,
| ①×2-② |
| 2 |
则△H=
| -2a+b |
| 2 |
| b-2a |
| 2 |
故选B.
点评:本题考查盖斯定律、反应热的计算等,难度中等,注意盖斯定律的理解与运用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
混合气体由N2和CH4组成,测得混合气体在标准状况下的密度为0.821g/L,则混合气体中N2和CH4的体积之比为( )
| A、5:1 | B、1:4 |
| C、4:1 | D、1:5 |
如图所示,电极a和b均为石墨棒,在电解过程中,下列说法正确的是( )
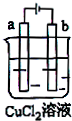

| A、电极a表面呈红色 |
| B、电极b表面有气泡生成 |
| C、电子由电源的正极沿导线流向电极a |
| D、该装置能量转化形式为电能转化为化学能 |
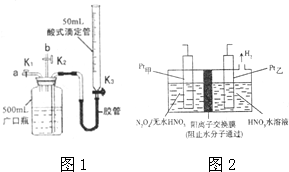

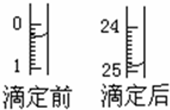 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定法测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定法测定其浓度.