题目内容
4.101kPa条件下,14gN2和3gH2反应生成NH3的能量变化如图示意: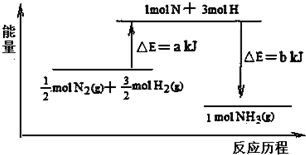
又已知:
①已知b=1173;
②25℃、101kPa下N2(g)+3H2 (g)?2NH3 (g)△H=-92kJ•mol-1
则a=1127.
分析 反应热=反应物中的键能之和-生成物中的键能之和求出a的值,由此分析解答.
解答 解:该反应放热,反应热=反应物的键能-生成物的键能,氮气和氢气反应生成氨气的热化学方程式为:
$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g)△H=a-bkJ•mol-1,则N2(g)+3H2 (g)=2NH3(g)△H=2(a-b)kJ•mol-1=-92kJ•mol-1,所以a-b=-46,又因b=1173,而a-b=-46,所以a=1127,故答案为:1127.
点评 本题主要考查了化学反应与能量的变化,难度不大,注意知识的积累,学生要注意反应热=反应物中的键能之和-生成物中的键能之和.

练习册系列答案
相关题目
14.用NA代表阿伏加德罗常数的值,下列有关说法正确的是( )
| A. | 78g过氧化钠晶体中,含2NA个阴离子 | |
| B. | 常温常压下,22.4L氦气含有NA个氦原子 | |
| C. | 在H2O2参与的反应中,1 mol H2O2得到或失去的电子数一定是2NA | |
| D. | 常温下16g O2与O3的混合气体中含氧原子数为NA |
15.下列说法或有关化学用语的表达正确的是( )
| A. | 第一电离能介于B、N之间的第二周期元素有1种 | |
| B. | 基态Fe原子的外围电子排布图为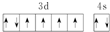 | |
| C. | 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 | |
| D. | 根据原子核外电子排布的特点,Cu在元素周期表中位于s区 |
13.下列“类推”合理的是( )
| A. | 加热CS2CO3可生成CS2O和CO2(CS:铯 IA) | |
| B. | 铊(Tl)与铝同族,其单质既能与HCl又能与NaOH溶液反应 | |
| C. | AgAt为白色沉淀,不溶于稀HNO3(At:砹 VⅡA) | |
| D. | Ra(OH)2是易溶于水的强碱(Ra:镭ⅡA) |
14.下列实验操作和结论错误的是( )
| A. | 用新制Cu(OH)2可鉴别麦芽糖和蔗糖 | |
| B. | 用银镜反应可证明淀粉是否转化为葡萄糖,但不能证明是否完全转化 | |
| C. | 浓H2SO4可使蔗糖脱水变黑,证明蔗糖含C,H,O三种元素 | |
| D. | 蔗糖溶液中滴加几滴稀H2SO4后,水溶加热几分钟,加入到银氨溶液中,不能发生银镜反应,证明蔗糖不水解 |
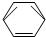 -CH2CH3$\stackrel{酸性KMn_{4}O_{2}溶液}{→}$C6H5-COOH
-CH2CH3$\stackrel{酸性KMn_{4}O_{2}溶液}{→}$C6H5-COOH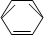 +HNO3 $→_{55~60℃}^{浓硫酸}$C6H5NO2 +H2O
+HNO3 $→_{55~60℃}^{浓硫酸}$C6H5NO2 +H2O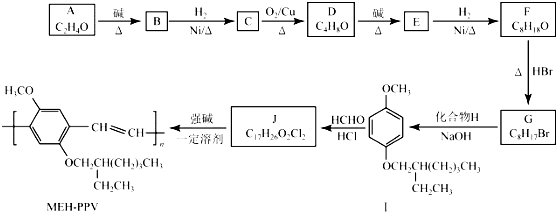
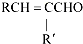 +H2O (R、R′表示烃基或氢)
+H2O (R、R′表示烃基或氢) (R、R′表示烃基烷氧基)
(R、R′表示烃基烷氧基)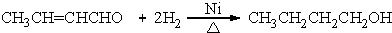 .
.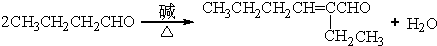 .
.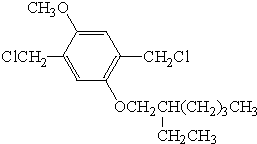 .
.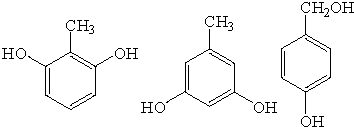 .
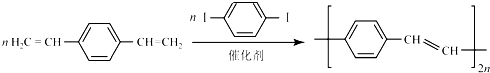
.
 、
、 .
.