题目内容
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100g10.00%的K2SO4溶液,电极均为石墨电极。

(1)接通电源,经过一段时间后,测得丙中K2SO4质量分数为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为_______________极;
②电极b上发生的电极反应为_______________;
③电极b上生成的气体在标准状况下的体积为_______________L;
④电极c的质量变化是__________g;
⑤电解前后各溶液的pH是否发生变化:
甲溶液______________;乙溶液_____________;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
练习册系列答案
相关题目
7.已知氧化性:Br2>Fe3+>I2,向含溶质a mol FeI2的溶液中加入含b mol Br2的溴水,充分反应.下列说法不正解的是( )
| A. | 离子的还原性强弱:I->Fe2+>Br- | |
| B. | 当a≥b时,发生的离子反应:2I-+Br2=I2+2Br- | |
| C. | 当5a=4b时,反应后的离子浓度之比:c(Fe2+):c(Fe3+):c(Br-)=1:1:5 | |
| D. | 当3a≤2b时,发生的离子反应:2Fe2++2I-+2Br2=I2+4Br-+2Fe3+ |





 2NH3(g) ΔH=-38.6kJ·mol-1
2NH3(g) ΔH=-38.6kJ·mol-1 -==2CO
-==2CO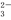 +12H2O、7H2O+7/2O2+14e-==14OH-,有关此电池的推断正确的是
+12H2O、7H2O+7/2O2+14e-==14OH-,有关此电池的推断正确的是 2SO3(g);ΔH=-Q1。在相同条件下,向一固定容积密闭容器中通入1 mol SO2和0.5 mol O2,达到平衡时放出的热量为Q2,则Q1、Q2满足的关系是( )
2SO3(g);ΔH=-Q1。在相同条件下,向一固定容积密闭容器中通入1 mol SO2和0.5 mol O2,达到平衡时放出的热量为Q2,则Q1、Q2满足的关系是( )